Baterai listrik

Baterai (serapan dari bahasa Belanda: batterij) adalah perangkat yang terdiri dari satu atau lebih sel elektrokimia dengan koneksi eksternal yang disediakan untuk memberi daya pada perangkat listrik seperti senter, ponsel, dan mobil listrik.[1] Ketika baterai memasok daya listrik, terminal positifnya adalah katode dan terminal negatifnya adalah anoda.[2] Terminal bertanda negatif adalah sumber elektron yang akan mengalir melalui rangkaian listrik eksternal ke terminal positif. Ketika baterai dihubungkan ke beban listrik eksternal, reaksi redoks mengubah reaktan berenergi tinggi ke produk berenergi lebih rendah, dan perbedaan energi-bebas dikirim ke sirkuit eksternal sebagai energi listrik.[3] Secara historis istilah "baterai" secara khusus mengacu pada perangkat yang terdiri dari beberapa sel, namun penggunaannya telah berkembang untuk memasukkan perangkat yang terdiri dari satu sel.[4]
Baterai primer (sekali pakai) digunakan satu kali kemudian dibuang; bahan elektrode berubah secara ireversibel selama pelepasan. Contoh umum adalah baterai alkalin yang digunakan untuk senter dan banyak perangkat elektronik portabel. Baterai sekunder (dapat diisi ulang) dapat habis dan diisi ulang beberapa kali menggunakan arus listrik yang diterapkan; komposisi asli dari elektrode dapat dikembalikan dengan arus balik. Contohnya termasuk baterai asam timbal yang digunakan dalam kendaraan dan baterai ion-litium yang digunakan untuk elektronik portabel seperti laptop dan ponsel.
Kutub yang bertanda positif menandakan bahwa memiliki energi potensial yang lebih tinggi daripada kutub bertanda negatif. Kutub bertanda negatif adalah sumber elektron yang ketika disambungkan dengan rangkaian eksternal akan mengalir dan memberikan energi ke peralatan eksternal. Ketika baterai dihubungkan dengan rangkaian eksternal, elektrolit dapat berpindah sebagai ion di dalamnya, sehingga terjadi reaksi kimia pada kedua kutubnya. Perpindahan ion dalam baterai akan mengalirkan arus listrik keluar dari baterai sehingga menghasilkan kerja.[5] Meski sebutan baterai secara teknis adalah alat dengan beberapa sel, sel tunggal juga umumnya disebut baterai.
Baterai hadir dalam berbagai bentuk dan ukuran, dari sel miniatur yang digunakan untuk alat bantu dengar dan arloji hingga kecil, sel tipis yang digunakan dalam ponsel cerdas, hingga baterai asam timbal besar atau baterai litium-ion dalam kendaraan, dan pada ukuran paling besar, bank baterai besar seukuran ruangan yang menyediakan daya siaga atau darurat untuk pertukaran telepon dan pusat data komputer.
Menurut perkiraan pada tahun 2005, industri baterai di seluruh dunia menghasilkan US$48 miliar dalam penjualan setiap tahun,[6] dengan pertumbuhan tahunan 6%.
Baterai memiliki energi spesifik yang jauh lebih rendah (energi per satuan massa) daripada bahan bakar umum seperti bensin. Pada mobil, ini sedikit diimbangi oleh efisiensi yang lebih tinggi dari motor listrik dalam mengubah energi kimia menjadi pekerjaan mekanik, dibandingkan dengan mesin pembakaran.
Prinsip operasi
[sunting | sunting sumber]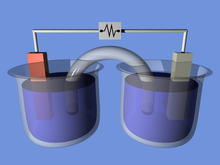
Baterai mengubah energi kimia langsung menjadi energi listrik. Baterai terdiri dari sejumlah sel volta. Tiap sel terdiri dari 2 sel setengah yang terhubung seri melalui elektrolit konduktif yang berisi anion dan kation. Satu sel setengah termasuk elektrolit dan elektrode negatif, elektrode yang di mana anion berpindah; sel-setengah lainnya termasuk elektrolit dan elektrode positif di mana kation berpindah. Reaksi redoks akan mengisi ulang baterai. Kation akan tereduksi (elektron akan bertambah) di katode ketika pengisian, sedangkan anion akan teroksidasi (elektron hilang) di anode ketika pengisian.[7] Ketika digunakan, proses ini dibalik. Elektrodanya tidak bersentuhan satu sama lain, tetapi terhubung via elektrolit. Beberapa sel menggunakan elektrolit yang berbeda untuk tiap sel setengah. Sebuah separator dapat membuat ion mengalir di antara sel-setengah dan bisa menghindari pencampuran elektrolit.
Tiap sel setengah memiliki gaya gerak listrik (GGL), ditentukan dari kemampuannya untuk menggerakan arus listrik dari dalam ke luar sel. GGL bersih sebuah sel adalah perbedaan GGL masing-masing sel setengah.[8] Maka, jika elektrode memiliki GGL dan , maka GGL bersihnya adalah . Dengan kata lain, GGL bersih adalah perbedaan antara potensial reduksi reaksi setengah.[9]
Perbedaan potensial pada kutub baterai dikenal dengan (perbedaan) tegangan kutub dan diukur dalam volt.[10] Tegangan kutub sebuah sel yang tidak sedang diisi ulang atau dipakai disebut tegangan rangkaian terbuka dan sama dengan GGL sel. Karena adanya resistensi dalam,[11] tegangan kutub pada sel yang dipakai lebih kecil daripada tegangan rangkaian terbuka dan ketika sel diisi ulang, akan lebih besar daripada tegangan rangkaian terbuka.[12]
Sebuah sel ideal memiliki resistensi dalam yang dapat diabaikan, maka sel tersebut akan menjaga tegangan terminal konstan sebesar sampai habis, kemudian turun menjadi nol. Jika sel menjaga 1,5 volt dan menyimpan muatan satu coulomb maka pada pelepasan total akan menghasilkan 1,5 joule kerja.[10] Pada sel sebenarnya, resistensi dalam akan meningkat ketika melepas muatan (discharge)[11] dan tegangan rangkaian terbuka juga menurun ketika melepas muatan. Jika tegangan dan hambatan diplot terhadap waktu, maka grafiknya biasanya berbentuk kurva.
Tegangan yang muncul melewati kutub sel tergantung dari energi yang dilepas dari reaksi kimia pada elektrode dan elektrolit. Sel baterai alkalin dan baterai seng karbon memiliki sifat kimia yang berbeda, tetapi menghasilkan GGL yang sama berkisar 1,5 volt. Begitu juga sel NiCd dan NiMH memiliki sifat kimia yang berbeda namun menghasilkan GGL sama sekitar 1,2 volt.[13]
Besar energi yang dapat disimpan baterai dipengaruhi oleh dua hal, yaitu tegangan baterai yang bersatuan volt dan kapasitas baterai yang bersatuan Ah. Energi yang disimpan (Wh) = Tegangan baterai (V) x Kapasitas baterai (Ah).
Tegangan baterai sendiri secara teoretik hanya dipengaruhi oleh tipe materialnya. Misal, pada baterai zink klorida, tidak peduli berapapun ukuran baterai, tegangannya ialah 2,12 V.[14] Lalu, kapasitas baterai dipengaruhi oleh ukuran baterai, atau lebih akurat adalah massa material aktif/elektrode yang ada di baterai tersebut.
Namun begitu, secara praktikal besar energi spesifik (energi/gram) yang dapat disimpan jauh lebih rendah daripada teoretik. Hal ini disebabkan terdapat komponen-komponen dalam baterai yang menambah berat baterai yaitu elektrolit, separator, current collector, kontainer, terminal, seal, dll.
Lalu, terdapat faktor seperti penurunan tegangan yang terjadi karena tiga hal. Yang pertama adalah terdapat hambatan dalam baterai yang disebabkan oleh hambatan ionik dari elektrolit dan juga hambatan elektronik dari komponen aktif baterai. Yang kedua adalah adanya polarisasi aktivasi, yaitu polarisasi yang terjadi karena reaksi elektrokimia pada permukaan elektrode. Yang ketiga adalah polarisasi konsentrasi, yaitu polarisasi yang terjadi karena perbedaan konsentrasi reaktan dengan produk pada elektrode yang disebabkan oleh transfer muatan.
Hingga saat ini, baterai sekunder atau isi ulang yang paling umum digunakan di handphone, laptop, maupun mobil listrik ialah baterai litium ion dengan elektrolit cair berupa LiPF6. Elektrolit tersebut sebenarnya memiliki tingkat keamanan yang relatif rendah dibanding karena sifatnya yang mudah bereaksi dengan udara dan terbakar.
Oleh karena itu, saat ini sedang dikembangkan elektrolit padat yang memiliki tingkat keamanan lebih tinggi. Sayangnya, konduktivitas ionik elektrolit padat masih secara umum di bawah elektrolit cair. Dengan begitu, hambatan dalam yang akan dimiliki oleh baterai dengan elektrolit padat secara umum lebih besar dan penurunan tegangan yang akan terjadi juga semakin besar.
Perkembangan mendatang
[sunting | sunting sumber]Pada tahap perkembangan baterai selanjutnya, salah satu baterai sekunder yang digunakan adalah baterai litium ion.[15] Hal ini dikenal juga sebagai bagian dari baterai generasi selanjutnya (next generation battery), yang sedang aktif diteliti di lab sebagai alternatif baru untuk baterai.[butuh rujukan] Namun, manusia selalu menginginkan yang lebih baik, terutama dari segi keamanan, rapat energi, dan rapat daya supaya memungkinkan berbagai aplikasi yang lebih canggih. Tiga contoh baterai generasi selanjutnya adalah baterai all solid state, baterai litium sulfur, dan baterai logam udara (metal-air).[15]
Baterai litium sulfur terdiri dari anode berupa logam litium dan katode berupa sulfur (S8). Kelebihan utama dari baterai litium sulfur adalah rapat energinya yang sangat tinggi secara teoretik yaitu 2.500 Wh/kg, sekitar lima kali rapat energi yang baterai litium ion yang saat ini ada di pasaran. Oleh karena itu, baterai ini dianggap sangat berprospek untuk aplikasi seperti mobil listrik yang membutuhkan penyimpanan banyak energi dalam ruangan dan berat yang kecil.[16][17] Namun begitu, ada satu kekurangan utama dari baterai litium sulfur. Kekurangan tersebut adalah umur baterai yang sangat rendah karena ketidakmampuan baterai untuk mengulang banyak siklus pemakaian. Setelah beberapa kali penggunaan, kapasitas baterai litium sulfur sudah turun sangat drastis menjadi rendah. Hal ini disebabkan terbentuknya senyawa-senyawa sulfida tak diinginkan pada saat proses pemakaian dan pengisian.[16][17]
Baterai logam udara merupakan baterai yang menggunakan logam sebagai anode dan udara (O2) sebagai katode. Ketiga logam yang digunakan adalah litium, maka baterai tersebut disebut dengan baterai litium-udara (bahasa Inggris: lithium-air) yang secara teoretik memiliki rapat energi 13.000 Wh/kg. Hal ini dimungkinkan karena anodanya yang berupa udara memiliki rapat energi yang sangat rendah. Baterai logam udara ini bisa dikatakan memiliki kerja yang hampir sama dengan fuel cell, yang menyimpan energi menggunakan gas H2 dan diisi dengan cara mengisi gas H2. Di sisi lain, baterai logam udara diisi dengan cara yang sama dengan mengecas baterai bisanya. Selain baterai litium-udara, baterai logam udara yang paling sering dikembangkan saat ini adalah baterai seng udara (zinc-air).[18]
Kekurangan yang menyebabkan baterai logam udara ini masih sangat jauh dari aplikasi komersial ada 4. Yang paling utama adalah sulitnya mendapatkan elektrolit yang cocok dan memiliki seluruh sifat yang diinginkan yaitu stabil dengan logam dan bisa melarutkan udara, tidak beracun, serta rentang elektrokimia yang luas. Kekurangan lainnya adalah pembentukan solid electrolyte interphase (SEI) karena logam bereaksi dengan elektrolit, risiko korsleting karena tumbuhnya dendrit, dan stabilitas katode tempat terjadi reaksi yang biasanya diperankan oleh karbon.[19]
Lihat pula
[sunting | sunting sumber]Orang/penemu
[sunting | sunting sumber]- John Frederic Daniell
- Thomas Edison
- Luigi Galvani
- Moritz von Jacobi
- Georges Leclanché
- Slavoljub Penkala
- Nikola Tesla
- Alessandro Volta
Topik listrik terkait
[sunting | sunting sumber]- Perbedaan potensial
- Kendaraan listrik
- Efisiensi listrik
- Listrik
- Sel elektrokimiawi
- Potensial elektrokimiawi
- Elektrokimia
- Gaya elektromotif
- Electroplating
- Penyimpanan energi
- Baterai lokal
- Pencatu daya
- Arus searah
- Tenaga surya
- Energi terbarui
Konsep elektronik terkait
[sunting | sunting sumber]- Rangkaian seri dan paralel
- Elektrode
- Kapasitor elektrolitik
- Sel bahan bakar
- Ignition system
- Baterai lemon
- Jump start
- Lantern
- Penyimpanan energi roda terbang
- Baterai isi ulang
- Teori daya maksimum
- Persamaan Nernst
- Penyimpanan energi superkonduksi magnetik
- Penyimpanan energi jaringan
Penemuan terkait
[sunting | sunting sumber]Lainnya
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ Crompton, T.R. (2000-03-20). Battery Reference Book (edisi ke-third). Newnes. hlm. Glossary 3. ISBN 978-0-08-049995-6. Diakses tanggal 2016-03-18.
- ^ Pauling, Linus (1988). "15: Oxidation-Reduction Reactions; Electrolysis.". General Chemistry. New York: Dover Publications, Inc. hlm. 539. ISBN 978-0-486-65622-9.
- ^ Schmidt-Rohr, Klaus (2018). "How Batteries Store and Release Energy: Explaining Basic Electrochemistry". Journal of Chemical Education. 95 (10): 1801–1810. Bibcode:2018JChEd..95.1801S. doi:10.1021/acs.jchemed.8b00479.
- ^ Pistoia, Gianfranco (2005-01-25). Batteries for Portable Devices. Elsevier. hlm. 1. ISBN 978-0-08-045556-3. Diakses tanggal 2016-03-18.
- ^ "Battery - Definition of battery by Merriam-Webster". merriam-webster.com.
- ^ Power Shift: DFJ on the lookout for more power source investments Diarsipkan 1 December 2005 di Wayback Machine..Draper Fisher Jurvetson. Retrieved 20 November 2005.
- ^ Dingrando 665.
- ^ Saslow 338.
- ^ Dingrando 666.
- ^ a b Knight 943.
- ^ a b Knight 976.
- ^ Terminal Voltage – Tiscali Reference Diarsipkan 2008-04-11 di Wayback Machine.. Originally from Hutchinson Encyclopaedia. Retrieved 7 April 2007.
- ^ Dingrando 674.
- ^ "Energy Data Conversion Handbook". 1984. doi:10.1007/978-1-349-07397-9.
- ^ a b Reddy, T. (2010). Linden's Handbook of Batteries, 4th Edition: McGraw-Hill Education.
- ^ a b L.C.L.L. Shaw, Recent advances in lithiumesulfur batteries, Journal of Power Sources, 267 (2014) 770 - 783.
- ^ a b G. Aldridge, Li-S Lithium Sulfur: An Energy Revolution, 2018.
- ^ F. Cheng, J. Chen, Metal–air batteries: from oxygen reduction electrochemistry to cathode catalysts, Chem Soc Rev, 41 (2012) 2172–2192.
- ^ D. Georgi, Metal Air Batteries, Half a Fuel Cell?, 42nd Power Sources Conference, 2010.
Pranala luar
[sunting | sunting sumber]- Electrochemistry Encyclopedia NONRECHARGEABLE BATTERIES Diarsipkan 2012-12-12 di Archive.is
- Battery Glossary & Terminology Diarsipkan 2006-04-12 di Wayback Machine.
- Battery Technologies Diarsipkan 2006-04-08 di Wayback Machine. - Directory page covering theory, research and development, and market devices that improve the trend toward clean, renewable energy. (FreeEnergyNews)
- Jet-Powered Computers, a look at future battery technologies by Fred Hapgood Diarsipkan 2006-07-20 di Wayback Machine.
- The Microturbine, battery technology as "the Next Big Thing" by Fred Hapgood Diarsipkan 2005-07-30 di Wayback Machine.
- Exide Technologies, a typical manufacturer of batteries for industrial and other applications
- Batteries in a Portable World - A Handbook on rechargeable batteries for non-engineers - Has a comprehensive FAQ section on rechargeable batteries
- Battery Timeline - History of batteries, energy and related technologies
- Mobile phone fuel cells coming in 2007 Infoworld July 13, 2005
- "Battery Resources" Diarsipkan 2006-02-13 di Wayback Machine. of PESWiki, the community-built website dealing with alternative and renewable energy solutions





