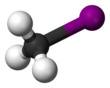
Iodometana

| |||
| |||
| Nama | |||
|---|---|---|---|
| Nama IUPAC
Iodometana[1]
| |||
Nama lain
| |||
| Penanda | |||
Model 3D (JSmol)
|
|||
| 3DMet | {{{3DMet}}} | ||
| Singkatan |
| ||
| Referensi Beilstein | 969135 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Nomor EC | |||
| Referensi Gmelin | 1233 | ||
| KEGG | |||
| MeSH | methyl+iodide | ||
PubChem CID
|
|||
| Nomor RTECS | {{{value}}} | ||
| Nomor UN | 2644 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Sifat | |||
| CH3I | |||
| Massa molar | 141,94 g·mol−1 | ||
| Penampilan | Cairan tak berwarna | ||
| Bau | menyengat, seperti eter[2] | ||
| Densitas | 2,28 g mL−1 | ||
| Titik lebur | 206,7 K | ||
| Titik didih | 315,5 sampai 315,9 K | ||
| 14 g L−1 (pada 20 °C (68 °F))[3] | |||
| log P | 1,609 | ||
| Tekanan uap | 54,4 kPa (at 20 °C (68 °F)) | ||
| kH | 1,4 μmol Pa−1 kg−1 | ||
| Indeks bias (nD) | 1,530–1,531 | ||
| Struktur | |||
| Tetrahedron | |||
| Termokimia | |||
| Kapasitas kalor (C) | 82,75 J K−1 mol−1 | ||
| Entalpi pembentukan standar (ΔfH |
−14,1–−13,1 kJ mol−1 | ||
| Entalpi pembakaran standar ΔcH |
−808,9–−808,3 kJ mol−1 | ||
| Bahaya | |||
| Piktogram GHS |  
| ||
| Keterangan bahaya GHS | {{{value}}} | ||
| H301, H312, H315, H331, H335, H351 | |||
| P261, P280, P301+310, P311 | |||
| Dosis atau konsentrasi letal (LD, LC): | |||
LD50 (dosis median)
|
| ||
LC50 (konsentrasi median)
|
1550 ppm (mencit, 30 menit) 860 ppm (tikus, 57 menit) 220 ppm (mencit, 4 jam)[4] | ||
LCLo (terendah tercatat)
|
3800 ppm (mencit, 15 menit)[4] | ||
| Batas imbas kesehatan AS (NIOSH): | |||
PEL (yang diperbolehkan)
|
TWA 5 ppm (28 mg/m3) [kulit][2] | ||
REL (yang direkomendasikan)
|
Ca TWA 2 ppm (10 mg/m3) [kulit][2] | ||
IDLH (langsung berbahaya)
|
Ca [100 ppm][2] | ||
| Senyawa terkait | |||
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |||
| Referensi | |||
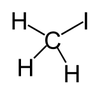

Iodometana, atau metil iodida (MeI), adalah suatu senyawa kimia dengan rumus molekul CH3I. Senyawa ini merupakan cairan dengan densitas dan tekanan uap yang tinggi. Senyawa ini merupakan turunan dari metana dengan salah satu atom hidrogen digantikan oleh atom iodin, dan memiliki momen dipol 1.59 D. Senyawa ini dapat bercampur dengan sempurna dalam pelarut-pelarut organik. Senyawa ini merupakan cairan tak berwarna, namun jika terkena cahaya, menimbulkan sedikit warna keunguan karena pembentukan iodin (I2). Proses ini dapat dihambat jika senyawa ini disimpan dalam logam tembaga. Metil iodida sering digunakan dalam sintesis organik, sebagai pemberi gugus metil. Senyawa ini dihasilkan dalam ladang beras dalam jumlah yang kecil.[5]
Metil iodida digunakan sebagai reagen substitusi nukleofilik, terutama SN2, karena memiliki halangan sterik yang kecil sehingga terbuka bagi serangan nukleofil, dan juga memiliki gugus pergi yang baik (iodida), sehingga senyawa ini amat reaktif dalam reaksi tersebut. Contohnya, senyawa ini digunakan dalam metilasi fenol atau asam karboksilat.
Referensi
[sunting | sunting sumber]- ^ "methyl iodide - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 26 March 2005. Identification. Diakses tanggal 25 February 2012.
- ^ a b c d "NIOSH Pocket Guide to Chemical Hazards #0420". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b Record dalam GESTIS Substance Database dari IFA
- ^ a b "Methyl iodide". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ K. R. Redeker, N.-Y. Wang, J. C. Low, A. McMillan, S. C. Tyler, and R. J. Cicerone (2000). "Emissions of Methyl Halides and Methane from Rice Paddies". Science. 290: 966–969. doi:10.1126/science.290.5493.966.