Reaksi SN2

Reaksi SN2 adalah suatu jenis mekanisme reaksi substitusi nukleofilik dalam kimia organik. Dalam mekanisme ini, salah satu ikatan terputus dan satu ikatan lainnya terbentuk secara bersamaan, dengan kata lain, dalam satu tahapan reaksi. Karena dua spesi yang bereaksi terlibat dalam suatu tahapan yang lambat (tahap penentu laju reaksi), hal ini mengarah pada nama substitusi nukleofilik (bi-molekular) atau SN2, jenis mekanisme utama lainnya adalah SN1.[1][2]
Jenis reaksi ini sangat umum dan karenanya memiliki bermacam-macam nama, seperti "substitusi nukleofilik bimolekular", atau, di antara kimiawan organik, "substitusi asosiatif" atau "mekanisme pertukaran".
Mekanisme reaksi
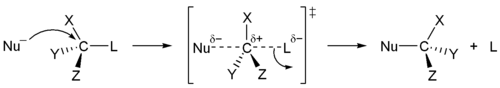
[sunting | sunting sumber]Reaksi SN2 sering kali terjadi pada pusat karbon sp3 alifatik dengan suatu gugus pergi yang bersifat stabil dan elektronegatif, menempel padanya (terkadang ditulis X), yang biasanya adalah suatu atom halida. Pemutusan ikatan C–X dan pembentukan ikatan baru (terkadang ditulis C–Y atau C–Nu) terjadi secara simultan melalui suatu keadaan transisi di mana suatu karbon yang menjadi target serangan nukleofilik adalah pentakoordinat, dan kira-kira terhibridisasi sp2.
| Substitusi nukleofilik pada karbon | |
|---|---|
 | |
| |
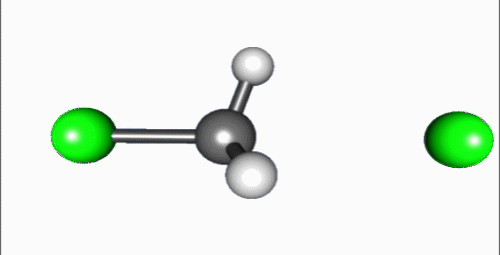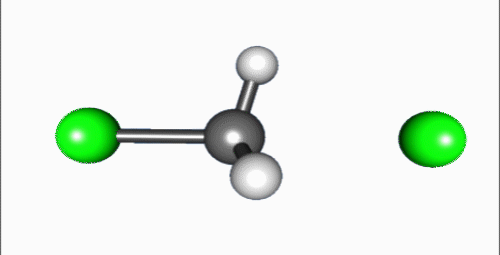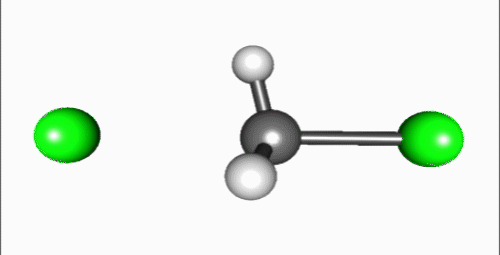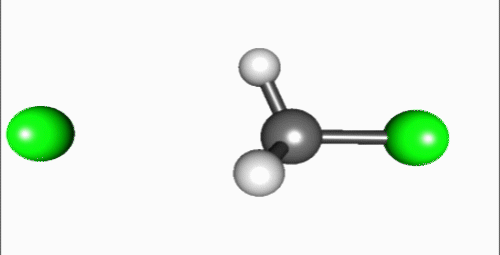
| Mekanisme SN2 | |
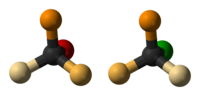
Penyerangan nukleofil pada karbon berlangsung 180° terhadap gugus pergi, karena hal tersebut menyediakan tumpang-tindih terbaik antara pasangan elektron sunyi pada nukleofil dan orbital anti-ikatan C–X σ*. Gugus pergi kemudian mendorong pada sisi berlawanan dan produk terbentuk melalui inversi pada geometri tetrahedral pada atom pusat.
Jika substrat yang menjadi target serangan nukleofilik besifat kiral, reaksi ini terkadang mengarah pada konfigurasi (stereokimia), yang disebut sebagai inversi Walden.[3]
Sebagai contoh reaksi SN2, penyerangan Br− (nukleofil) pada suatu etil klorida (elektrofil) menghasilkan etil bromida, dengan klorida lepas sebagai gugus pergi:

Penyerangan pada SN2 dapat terjadi jika rute sisi belakang penyerangan tidak terdapat halangan sterik oleh substituen atau substrat. Karenanya, mekanisme ini biasanya terjadi pada suatu pusat karbon primer yang tak terhalang. Jika terdapat halangan sterik pada substrat dekat gugus pergi, seperti pada pusat karbon tersier, substitusi yang terjadi lebih disukai mengikuti mekanisme SN1 dibandingkan SN2, (SN1 dapat pula disukai bila zat antara karbokation yang stabil dapat terbentuk).[2][4]
Kinetika reaksi
[sunting | sunting sumber]
Laju reaksi SN2 mengikuti kinetika reaksi orde kedua, karena tahap penentu laju reaksi bergantung pada konsentrasi nukleofil, [Nu−] serta konsentrasi substrat, [RX].
- r = k[RX][Nu−]
Hal ini merupakan perbedaan utama antara mekanisme SN1 dan SN2. Dalam reaksi SN1 penyerangan nukleofil setelah tahap penentu laju langsung selesai, sementara dalam SN2 nukleofil memaksa gugus pergi untuk lepas dalam tahap penentu laju. Dengan kata lain, laju reaksi SN1 hanya bergantung pada konsentrasi substrat sementara laju reaksi SN2 bergantung pada konsentrasi substrat dan nukleofil.
Dalam kasus di mana kedua mekanisme memungkinkan untuk terjadi (misalnya pada suatu pusat karbon sekunder), mekanisme bergantung pada pelarut, suhu, konsentrasi nukleofil atau pada gugus pergi.

Kompetisi E2
[sunting | sunting sumber]Suatu reaksi samping yang umum terjadi di lokasi yang sama dengan reaksi SN2 adalah eliminasi E2: anion yang datang dapat berperan sebagai basa daripada suatu nukleofil, menarik proton dan mengarah pada pembentukan alkena. Reaksi E2 umum terjadi ketika ion yang datang memiliki halangan sterik sehingga penarikan proton menjadi lebih mudah. Reaksi eliminasi biasanya lebih disukai pada suhu yang meningkat[5] karena bertambahnya entropi. Efek ini dapat ditunjukkan dalam reaksi fasa gas antara sulfonat dan suatu alkil bromida sederhana yang terjadi di dalam spektrometer massa:[6][7]
| Eksperimen kompetisi antara SN2 dan E2 |
|---|
Dengan etil bromida, produk reaksi substitusi lebih mendominasi. Karena halangan sterik di sekitar pusat elektrofilik bertambah, seperti halnya isobutil bromida, substitusi lebih tidak disukai dan eliminasi merupakan produk yang mendominasi. Faktor lain yang membuat eliminasi lebih disukai adalah kekuatan basa. Dengan substrat benzoat yang kurang basa, isopropil bromida bereaksi dengan 55% substitusi.
Lihat pula
[sunting | sunting sumber]- Reaksi substitusi
- Substitusi nukleofilik
- Substitusi elektrofilik
- Reaksi SN1
- Reaksi SNi
- Partisipasi gugus tetangga
Referensi
[sunting | sunting sumber]- ^ L. G. Wade, Jr., Organic Chemistry, 6th ed., Pearson/Prentice Hall, Upper Saddle River, New Jersey, USA, 2005.
- ^ a b March, Jerry (1985). Advanced Organic Chemistry, Reactions, Mechanisms and Structure (dalam bahasa Inggris) (edisi ke-3). John Wiley & Sons. ISBN 0-471-85472-7.
- ^ The Walden cycle revisited: a computational study of competitive ring closure to α- and β-lactones J. Grant Buchanan, Richard A. Diggle, Giuseppe D. Ruggiero and Ian H. Williams Chemical Communications, 2006, 1106 - 1108 doi:10.1039/b517461a.
- ^ Imyanitov, Naum S. (1993). "Is This Reaction a Substitution, Oxidation-Reduction, or Transfer?". J. Chem. Educ. 70 (1): 14–16. Bibcode:1993JChEd..70...14I. doi:10.1021/ed070p14.
- ^ http://www.masterorganicchemistry.com/2012/09/10/elimination-reactions-are-favored-by-heat/
- ^ Gas Phase Studies of the Competition between Substitution and Elimination Reactions Scott Gronert Acc. Chem. Res.; 2003; 36(11) pp 848 - 857; (Article) doi:10.1021/ar020042n
- ^ Teknik yang digunakan adalah ionisasi electrospray dan karena membutuhkan produk reaksi bermuatan untuk deteksi nukleofil ini dilengkapi dengan gugus anionik sulfonat tambahan, non-reaktif dan mudah dipisahkan dari anion lainnya. Rasio produk substitusi dan produk eliminasi dapat diukur dari intensitas ion molekul relatifnya
Pranala luar
[sunting | sunting sumber] Media tentang Reaksi SN2 di Wikimedia Commons
Media tentang Reaksi SN2 di Wikimedia Commons

