1-Propanol

| |
| Nama | |
|---|---|
| Nama IUPAC
Propan-1-ol[1]
| |
Nama lain
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Referensi Beilstein | 1098242 |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| Nomor EC | |
| Referensi Gmelin | 25616 |
| KEGG | |
| MeSH | 1-Propanol |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 1274 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C3H8O | |
| Massa molar | 60,10 g·mol−1 |
| Penampilan | Cairan tak berwarna |
| Bau | lembut, seperti alkohol[2] |
| Densitas | 0,803 g/mL |
| Titik lebur | −126 °C; −195 °F; 147 K |
| Titik didih | [convert: unit tak dikenal] |
| dapat campur | |
| log P | 0,329 |
| Tekanan uap | 1,99 kPa (pada 20 °C) |
| Keasaman (pKa) | 16 |
| Kebasaan (pKb) | −2 |
| Indeks bias (nD) | 1,387 |
| Viskositas | 1,959 mPa×s (pada 25 °C)[3] |
| 1,68 D | |
| Termokimia | |
| Kapasitas kalor (C) | 143,96 J K−1 mol−1 |
| Entropi molar standar (S |
192,8 J K−1 mol−1 |
| Entalpi pembentukan standar (ΔfH |
−302,79–−302,29 kJ mol−1 |
| Entalpi pembakaran standar ΔcH |
−2,02156–−2,02106 MJ mol−1 |
| Farmakologi | |
| Kode ATC | D08 |
| Bahaya | |
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H225, H318, H336 | |
| P210, P261, P280, P305+351+338 | |
| Titik nyala | 22 °C (72 °F; 295 K) |
| 371 °C (700 °F; 644 K) | |
| Ambang ledakan | 2,2% - 13.7%[2] |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
2800 mg/kg (kelinci, oral) 6800 mg/kg (tikus, oral) 1870 mg/kg (mencit, oral)[4] |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
TWA 200 ppm (500 mg/m3)[2] |
REL (yang direkomendasikan)
|
TWA 200 ppm (500 mg/m3) ST 250 ppm (625 mg/m3) [skin][2] |
IDLH (langsung berbahaya)
|
800 ppm[2] |
| Senyawa terkait | |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
1-Propanol adalah alkohol primer dengan rumus molekul CH3CH2CH2OH. Berbentuk cairan tak berwarna dan dikenal juga sebagai propan-1-ol, 1-propil alkohol, n-propil alkohol, dan n-propanol. Ini merupakan isomer dari isopropanol (2-propanol, isopropil alkohol). Senyawa ini terbentuk secara alami dalam jumlah kecil selama proses fermentasi dan digunakan sebagai pelarut dalam industri farmasi, terutama untuk resin dan ester selulosa.
Sifat kimia
[sunting | sunting sumber]1-Propanol menunjukkan reaksi normal selayaknya alkohol primer. Oleh karenanya dapat dikonversi menjadi alkil halida; sebagai contoh fosfor merah dan iodium menghasilkan n-propil iodida dengan rendemen 80%, sementara dengan PCl3 dengan katalis ZnCl2 menghasilkan 1-kloropropana. Reaksi dengan asam asetat dengan keberadaan katalis H2SO4 pada kondisi eseterifikasi Fischer menghasilkan propil asetat. Sementar merefluks propanol selama satu malam dengan asam format menghasilkan propil format dengan rendemen 65%. Oksidasi 1-propanol dengan Na2Cr2O7 dan H2SO4 menghasilkan propionaldehida dengan rendemen hanya 36%, dan oleh karenanya untuk reaksi jenis ini direkomendasikan menggunakan PCC atau oksidasi Swern untuk meningkatkan rendemen. Oksidasi dengan asam kromat menghasilkan asam propionat.
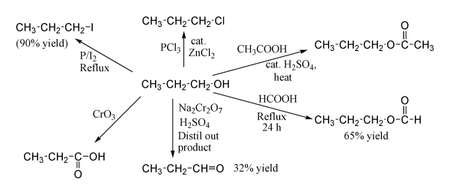
Preparasi
[sunting | sunting sumber]1-Propanol dibuat dengan hidrogenasi katalitik propionaldehida. Propionaldehida sendiri diproduksi melalui proses okso, dengan hidroformilasi etilena menggunakan karbon monoksida dan hidrogen dengan katalis kobalt oktakarbonil atau kompleks rodium.[5]
- H2C=CH2 + CO + H2 → CH3CH2CH=O
- CH3CH2CH=O + H2 → CH3CH2CH2OH
Preparasi laboratorium tradisional 1-propanol melibatkan perlakuan terhadap n-propil iodida dengan uap Ag2O.
1-Propanol ditemukan tahun 1853 oleh Chancel, yang mengamatinya distilasi fraksi minyak fusel. 1-Propanol adalah konstituen utama dalam minyak fusel, sementara produk sampingannya berupa asam amino ketika kentang atau bijih difermentasi untuk memproduksi etanol. Proses ini tidak lagi sumber utama 1-propanol.
Keselamatan kerja
[sunting | sunting sumber]1-Propanol mempunyai pengaruh terhadap tubuh manusia yang sama dengan etanol, tetapi 2-4 kali lebih kuat. LD50 oral mencit sekitar 1870 mg/kg (bandingkan dengan 7060 mg/kg untuk etanol). 1-Propanol dimetabolisme minjadi asam propionat. Pengaruhnya mencakup intoksikasi alkohol dan high anion gap metabolic acidosis. Pada tahun 2011, hanya satu kasus kematian akibat 1-propanol yang dilaporkan.[6]
Inhalasi
[sunting | sunting sumber]Meskipun metode ini jarang digunakan, tetapi ada. Propanol jauh lebih nyaman daripada etanol untuk inhalasi karena potensinya dengan nebulisator.
Propanol sebagai bahan bakar
[sunting | sunting sumber]1-Propanol mempunyai nilai oktana yang tinggi dan oleh karenanya cocok digunakan sebagai bahan bakar mesin. Meski demikian, produksi propanol jauh lebih mahal daripada bahan bakar konvensional. Nilai oktana riset (En: Research octane number, RON) propanol adalah 118 dan Indeks anti-ketukan (En: Anti-Knock Index, AKI) nya adalah 108
Referensi
[sunting | sunting sumber]- ^ "1-Propanol - Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 26 March 2005. Identification and Related Records. Diakses tanggal 10 October 2011.
- ^ a b c d e "NIOSH Pocket Guide to Chemical Hazards #0533". National Institute for Occupational Safety and Health (NIOSH).
- ^ Pal, Amalendu; Gaba, Rekha (2008). "Volumetric, acoustic, and viscometric studies of molecular interactions in binary mixtures of dipropylene glycol dimethyl ether with 1-alkanols at 298.15 K". The Journal of Chemical Thermodynamics. 40 (5): 818–828. doi:10.1016/j.jct.2008.01.008.
- ^ "n-Propyl alcohol". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Anthony J. Papa "Propanols" in Ullmann’s Encyclopedia of Industrial Chemistry 2011, Wiley-VCH, Weinheim. doi:10.1002/14356007.a22_173.pub2
- ^ "N-PROPANOL Health-Base Assessment and Recommendation for HEAC". Diarsipkan dari versi asli tanggal 2012-08-07. Diakses tanggal 2015-12-04.
Bibliografi
[sunting | sunting sumber]- Furniss, B. S.; Hannaford, A. J.; Smith, P. W. G.; Tatchell, A. R. (1989), Vogel's Textbook of Practical Organic Chemistry (5th ed.), Harlow: Longman, ISBN 0-582-46236-3
- Lide, David R., ed. (2006-06-26). CRC Handbook of Chemistry and Physics, 87th Edition (edisi ke-87). TF-CRC. ISBN 0-8493-0487-3.
- Maryadele J. O'Neil, ed. (2006-11-03). The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals (edisi ke-14). Merck. ISBN 0-911910-00-X.
- Perkin, W. H.; Kipping, F. S (1922). Organic Chemistry. London: W. & R. Chambers. ISBN 0-08-022354-0.
