Barium klorida
| |

| |
| Nama | |
|---|---|
| Nama lain
Barium muriat
Barium dichloride | |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| BaCl2 | |
| Massa molar | 208,23 g/mol (anhidrat) 244,26 g/mol (dihidrat) |
| Penampilan | Padatan putih |
| Densitas | 3,856 g/cm3 (anhidrat) 3.0979 g/cm3 (dihidrat) |
| Titik lebur | 962 °C (960 °C, dihidrat) |
| Titik didih | 1560 °C |
| 31.2 g/100 mL (0 °C) 35.8 g/100 mL (20 °C) 59.4 g/100 mL (100 °C) | |
| Kelarutan | Larut dalam metanol, tidak larut dalam etanol, etil asetat[1] |
| Struktur | |
| ortogonal (anhidrat) monoklinik (dihidrat) | |
| 7-9 | |
| Termokimia | |
| Entalpi pembentukan standar (ΔfH |
−858,56 kJ/mol |
| Bahaya | |
Klasifikasi UE (DSD) (usang)
|
Beracun (T) Berbahaya (Xn) |
| Frasa-R | R20, R25 |
| Frasa-S | (S1/2), S45 |
| Titik nyala | Tidak-terbakar |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
78 mg/kg (mencit, oral) 50 mg/kg (marmot, oral)[3] |
LDLo (terendah tercatat)
|
112 mg Ba/kg (kelinci, oral) 59 mg Ba/kg (anjing, oral) 46 mg Ba/kg (tikus, oral)[3] |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
TWA 0,5 mg/m3[2] |
REL (yang direkomendasikan)
|
TWA 0,5 mg/m3[2] |
IDLH (langsung berbahaya)
|
50 mg/m3[2] |
| Senyawa terkait | |
Anion lain
|
Barium fluorida Barium bromida Barium iodida |
Kation lainnya
|
Berilium klorida Magnesium klorida Kalsium klorida Stronsium klorida Radium klorida Timbal klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Barium klorida adalah senyawa anorganik dengan rumus BaCl2 yang tersusun dari ion Ba2+ dan Cl−. Garam ini merupakan salah satu garam barium yang umum larut dalam air dan bersifat higroskopik, membentuk senyawa hidrat BaCl2.2H2O.[4] Garam ini memiliki karakter padatan berwarna putih, sangat beracun, dan dapat memberikan warna hijau-kuning khas barium pada uji nyala.
Pembuatan
[sunting | sunting sumber]Dalam skala industri, barium klorida diproduksi dari mineral barit (barium sulfat) melalui dua proses. Proses pertama melibatkan reduksi pada suhu panas menggunakan karbon.
BaSO4 + 4 C → BaS + 4 CO
Proses kedua melibatkan reaksi substitusi dengan asam klorida.[5]
BaS + 2 HCl → BaCl2 + H2S
Reaksi kedua dapat juga diganti dengan menggunakan kalsium klorida.[6] Produk barium klorida karena mudah larut dalam air dapat diekstraksi dari campuran tersebut dan dikristalkan dalam bentuk hidratnya, BaCl2.2H2O. Senyawa ini juga dapat disintesis dari barium hidroksida.
Ba(OH)2 + 2 HCl → BaCl2 + 2 H2O
Barium klorida juga dapat dibuat dari barium karbonat dengan asam yang sama.
BaCO3 + 2 HCl → BaCl2 + H2O + CO2
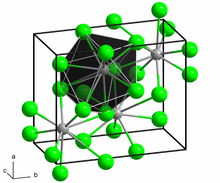
Struktur dan Sifat
[sunting | sunting sumber]BaCl2 mengkristal dalam dua struktur kristal (polimorf), yakni kisi ortorombik cotunnite (PbCl2) pada suhu ruang dan kisi kubik fluorit (CaF2) pada 925–963 °C.[7] Dalam kisi cotunnite, ion barium memiliki bilangan koordinasi 9, sedangkan pada kisi fluorit, ion tersebut memiliki bilangan koordinasi 8.[8][9] Dalam tekanan tinggi, garam dengan kisi contunnite ini berubah dan mengadopsi kisi monoklin dengan bilangan koordinasi ion Ba2+ berubah menjadi 10.[10]
Di dalam larutan berair, BaCl2 bertindak seperti garam alkali tanah yang larut di dalam air. Garam ini terdisosiasi menjadi 3 ion, yakni 1 ion Ba2+ dan 2 ion Cl−. Larutan yang terbentuk dapat digunakan untuk mengidentifikasi keberadaan ion sulfat secara kualitatif karena dapat bereaksi membentuk endapan putih barium sulfat.
BaCl2 + Na2SO4 → 2 NaCl + BaSO4(s)
Larutan ini dapat juga bereaksi dengan oksalat dengan stoikiometri yang sama. Apabila dicampur dengan natrium hidroksida, produk yang terbentuk adalah barium hidroksida yang kurang larut di air.
BaCl2 + 2 NaOH → 2 NaCl + Ba(OH)2
Hidrat BaCl2.2H2O bersifat stabil di keadaan ruang, tetapi melepas satu molekul air pada 55 °C menjadi BaCl2·H2O. Pada suhu di atas 121 °C, garam ini melepaskan seluruh airnya menjadi anhidrat BaCl2.[6]
Manfaat
[sunting | sunting sumber]Barium klorida dapat digunakan dalam berbagai bidang. Dalam bidang kimia, garam ini sering digunakan dalam penentuan kadar ion sulfat menggunakan metode gravimetri. Endapan barium sulfat disaring menggunakan kertas nirabu, dibakar di suatu oven, dan ditimbang untuk menentukan kemurnian senyawa sulfat yang dianalisis. Barium klorida pun juga banyak dimanfaatkan dalam pembuatan kembang api untuk memberikan warna hijau.[11]
Selain itu, material ini dapat digunakan dalam bidang industri dalam pemurnian brine 'air garam' dan pigmen seperti merah Lithol dan Red Lake C.
Namun, kegunaannya dihambat oleh tingkat keracunan ion barium. Sebagaimana garam barium lain yang larut di dalam air, senyawa ini menyebabkan iritasi pada mata dan kulit serta merusak ginjal. Gejala dari keracunan sistemik barium klorida meliputi nyeri perut, diare, pusing, muntah, lumpuh, dan bahkan kematian. Ion Ba2+ berinteraksi dengan sistem saraf yang menggunakan ion Ca2+[12] dan K+ sehingga dapat menyebabkan kelumpuhan.
Referensi
[sunting | sunting sumber]- ^ Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0045". National Institute for Occupational Safety and Health (NIOSH).
- ^ a b "Barium (soluble compounds, as Ba)". Immediately Dangerous to Life and Health. National Institute for Occupational Safety and Health (NIOSH).
- ^ Lumpkin, Janice Antoine; Perlmutter, Daniel D. (1995-01-16). "Thermal and water vapor effects on the rate of the dehydration reactions of barium chloride". Thermochimica Acta. 249: 335–349. doi:10.1016/0040-6031(95)90720-3. ISSN 0040-6031.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (edisi ke-2). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ a b "Barium Chloride - an overview | ScienceDirect Topics". www.sciencedirect.com. Diakses tanggal 2024-11-19.
- ^ Edgar, A.; Zimmermann, J.; von Seggern, H.; Varoy, C. R. (2010-04-15). "Lanthanum-stabilized europium-doped cubic barium chloride: An efficient x-ray phosphor". Journal of Applied Physics. 107 (8). doi:10.1063/1.3369162. ISSN 0021-8979.
- ^ Brackett, Elizabeth B.; Brackett, Thomas E.; Sass, Ronald L. (1963-10). "THE CRYSTAL STRUCTURES OF BARIUM CHLORIDE, BARIUM BROMIDE, AND BARIUM IODIDE". The Journal of Physical Chemistry. 67 (10): 2132–2135. doi:10.1021/j100804a038. ISSN 0022-3654.
- ^ Haase, A.; Brauer, G. (1978-06). "Hydratstufen und Kristallstrukturen von Bariumchlorid". Zeitschrift für anorganische und allgemeine Chemie. 441 (1): 181–195. doi:10.1002/zaac.19784410120. ISSN 0044-2313.
- ^ Léger, J. M.; Haines, J.; Atouf, A. (1995-08-01). "The Post-Cotunnite Phase in BaCl2, BaBr2 and BaI2 under High Pressure". Journal of Applied Crystallography. 28 (4): 416–423. doi:10.1107/S0021889895001580. ISSN 0021-8898.
- ^ De Antonis, Kathy. "Fireworks!" (PDF). ChemMatters. 28 (3). hlm. 8-10. Diakses tanggal 2024-11-19.
- ^ McLachlan, E M (1977-05). "The effects of strontium and barium ions at synapses in sympathetic ganglia". The Journal of Physiology. 267 (2): 497–518. doi:10.1113/jphysiol.1977.sp011823. ISSN 0022-3751. PMC 1283625
 . PMID 195042.
. PMID 195042.
