Laktam beta
Cincin Laktam beta (β-lactam) adalah laktam beranggota empat.[1] Laktam adalah suatu amida siklik, dan laktam beta dinamakan demikian karena atom nitrogen terikat pada atom karbon β relatif terhadap karbonil. β-laktam yang paling sederhana adalah 2-azetidinon. β-laktam adalah unit struktural penting dari obat-obatan seperti yang dimanifestasikan dalam banyak antibiotik beta-laktam.[2] Hingga tahun 1970, sebagian besar penelitian β-laktam berkaitan dengan kelompok penisilin dan sefalosporin, namun sejak itu, beragam struktur telah dijelaskan.[3][4]
Signifikansi klinis
[sunting | sunting sumber]
Cincin β-laktam adalah bagian dari struktur inti beberapa keluarga antibiotik, yang utama adalah penisilin, sefalosporin, karbapenem, dan monobaktam, yang oleh karena itu disebut juga antibiotik beta-laktam. Hampir semua antibiotik ini bekerja dengan menghambat biosintesis dinding sel bakteri. Hal ini memiliki efek mematikan pada bakteri, meskipun populasi bakteri tertentu biasanya mengandung subkelompok yang resisten terhadap antibiotik β-laktam. Resistensi bakteri terjadi sebagai akibat dari ekspresi salah satu dari banyak gen yang memproduksi β-laktamase, suatu kelas enzim yang memecah cincin β-laktam. Lebih dari 1.800 enzim β-laktamase berbeda telah didokumentasikan pada berbagai spesies bakteri.[5] Enzim-enzim ini sangat bervariasi dalam struktur kimia dan efisiensi katalitiknya.[6] Ketika populasi bakteri memiliki subkelompok yang resisten, pengobatan dengan β-laktam dapat menyebabkan strain yang resisten menjadi lebih umum dan lebih ganas. Antibiotik turunan β-laktam dapat dianggap sebagai salah satu kelas antibiotik yang paling penting namun rentan terhadap resistensi klinis. β-laktam menunjukkan sifat antibiotiknya dengan meniru substrat d-Ala-d-Ala yang terjadi secara alami untuk kelompok enzim yang dikenal sebagai protein pengikat penisilin (PBP), yang berfungsi untuk mengikat silang bagian peptidoglikan pada dinding sel bakteri.[7]
Cincin β-laktam juga ditemukan pada beberapa obat lain seperti obat penghambat penyerapan kolesterol ezetimibe.
Sintesis
[sunting | sunting sumber]β-laktam sintetik pertama dibuat oleh Hermann Staudinger pada tahun 1907 melalui reaksi basa Schiff dari anilin dan benzaldehida dengan difenilketena[8][9] dalam sikloadisi [2+2] (Ph menunjukkan gugus fungsi fenil):
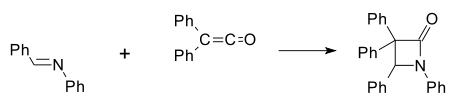 Banyak metode telah dikembangkan untuk sintesis β-laktam.[10][11][12]
Banyak metode telah dikembangkan untuk sintesis β-laktam.[10][11][12]
Sintesis Breckpot β-laktam[13] menghasilkan β-laktam tersubstitusi melalui siklisasi ester asam amino beta dengan menggunakan pereaksi Grignard.[14] Pereaksi Mukaiyama juga digunakan dalam sintesis Breckpot yang dimodifikasi.[13]

Reaksi
[sunting | sunting sumber]Karena regangan cincin, β-laktam lebih mudah dihidrolisis dibandingkan Amida linier atau laktam yang lebih besar. Strain ini semakin meningkat melalui fusi ke cincin kedua, seperti yang ditemukan pada sebagian besar antibiotik β-laktam. Kecenderungan ini disebabkan oleh karakter Amida dari β-laktam yang tereduksi oleh aplanaritas sistem. Atom nitrogen dari Amida ideal terhibridisasi sp2 karena resonansi, dan atom terhibridisasi sp2 mempunyai geometri ikatan trigonal planar. Ketika geometri ikatan piramidal dipaksakan pada atom nitrogen oleh regangan cincin, resonansi ikatan Amida berkurang, dan karbonil menjadi lebih mirip keton. Peraih Nobel Robert Burns Woodward menggambarkan parameter h sebagai ukuran tinggi piramida trigonal yang ditentukan oleh nitrogen (sebagai puncak) dan tiga atom yang berdekatan. h sesuai dengan kekuatan ikatan β-laktam dengan angka yang lebih rendah (lebih planar; lebih mirip amino ideal) menjadi lebih kuat dan kurang reaktif.[15] Monobaktam memiliki nilai h antara 0,05 dan 0,10 ångström (Å). Cephem memiliki nilai h sebesar 0,20–0,25 Å. Penam memiliki nilai dalam kisaran 0,40–0,50 Å, sedangkan karbapenem dan kladam memiliki nilai 0,50–0,60 Å, menjadi β-laktam yang paling reaktif terhadap hidrolisis.[16]
Referensi
[sunting | sunting sumber]- ^ Gilchrist T (1987). Heterocyclic Chemistry. Harlow: Longman Scientific. ISBN 978-0-582-01421-3.
- ^ Fisher, J. F.; Meroueh, S. O.; Mobashery, S. (2005). "Bacterial resistance to β-lactam antibiotics: compelling opportunism, compelling opportunity". Chemical Reviews. 105 (2): 395–424. doi:10.1021/cr030102i. PMID 15700950.
- ^ Flynn EH (1972). Cephalosporins and Penicillins : Chemistry and Biology. New York and London: Academic Press.
- ^ Hosseyni S, Jarrahpour A (October 2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry. 16 (38): 6840–6852. doi:10.1039/c8ob01833b. PMID 30209477.
- ^ Brandt C, Braun SD, Stein C, Slickers P, Ehricht R, Pletz MW, Makarewicz O (February 2017). "In silico serine β-lactamases analysis reveals a huge potential resistome in environmental and pathogenic species". Scientific Reports. 7: 43232. Bibcode:2017NatSR...743232B. doi:10.1038/srep43232. PMC 5324141
 . PMID 28233789.
. PMID 28233789.
- ^ Ehmann DE, Jahić H, Ross PL, Gu RF, Hu J, Kern G, Walkup GK, Fisher SL (July 2012). "Avibactam is a covalent, reversible, non-β-lactam β-lactamase inhibitor". Proceedings of the National Academy of Sciences of the United States of America. 109 (29): 11663–8. Bibcode:2012PNAS..10911663E. doi:10.1073/pnas.1205073109
 . PMC 3406822
. PMC 3406822  . PMID 22753474.
. PMID 22753474.
- ^ Tipper DJ, Strominger JL (October 1965). "Mechanism of action of penicillins: a proposal based on their structural similarity to acyl-D-alanyl-D-alanine". Proceedings of the National Academy of Sciences of the United States of America. 54 (4): 1133–41. Bibcode:1965PNAS...54.1133T. doi:10.1073/pnas.54.4.1133
 . PMC 219812
. PMC 219812  . PMID 5219821.
. PMID 5219821.
- ^ Tidwell TT (2008). "Hugo (Ugo) Schiff, Schiff bases, and a century of beta-lactam synthesis". Angewandte Chemie. 47 (6): 1016–20. doi:10.1002/anie.200702965. PMID 18022986.
- ^ Staudinger H (1907). "Zur Kenntniss der Ketene. Diphenylketen". Justus Liebigs Ann. Chem. 356 (1–2): 51–123. doi:10.1002/jlac.19073560106. Diarsipkan dari versi asli tanggal 2020-08-02. Diakses tanggal 2019-06-27.
- ^ Alcaide, Benito; Almendros, Pedro; Aragoncillo, Cristina (2007). "Β-Lactams: Versatile Building Blocks for the Stereoselective Synthesis of Non-β-Lactam Products". Chemical Reviews. 107 (11): 4437–4492. doi:10.1021/cr0307300. PMID 17649981.
- ^ Hosseyni, Seyedmorteza; Jarrahpour, Aliasghar (2018). "Recent advances in β-lactam synthesis". Organic & Biomolecular Chemistry (dalam bahasa Inggris). 16 (38): 6840–6852. doi:10.1039/C8OB01833B. ISSN 1477-0520. PMID 30209477.
- ^ Pitts, Cody Ross; Lectka, Thomas (2014-08-27). "Chemical Synthesis of β-Lactams: Asymmetric Catalysis and Other Recent Advances". Chemical Reviews (dalam bahasa Inggris). 114 (16): 7930–7953. doi:10.1021/cr4005549. ISSN 0009-2665. PMID 24555548. Diarsipkan dari versi asli tanggal 2022-07-21. Diakses tanggal 2020-12-17.
- ^ a b "Breckpot β-Lactam Synthesis", Comprehensive Organic Name Reactions and Reagents (dalam bahasa Inggris), Hoboken, NJ, USA: John Wiley & Sons, Inc., hlm. 521–524, 2010-09-15, doi:10.1002/9780470638859.conrr115, ISBN 978-0-470-63885-9, diarsipkan dari versi asli tanggal 2024-01-16, diakses tanggal 2021-02-04
- ^ Bogdanov B, Zdravkovski Z, Hristovski K. "Breckpot Synthesis". Institute of Chemistry Skopje. Diarsipkan dari versi asli tanggal 2015-11-06. Diakses tanggal 2014-12-30.
- ^ Woodward RB (May 1980). "Penems and related substances". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 289 (1036): 239–50. Bibcode:1980RSPTB.289..239W. doi:10.1098/rstb.1980.0042
 . PMID 6109320.
. PMID 6109320.
- ^ Nangia A, Biradha K, Desiraju GR (1996). "Correlation of biological activity in β-lactam antibiotics with Woodward and Cohen structural parameters: A Cambridge database study". J. Chem. Soc. Perkin Trans. 2 (5): 943–53. doi:10.1039/p29960000943.
