Paraldehida

| |
| Nama | |
|---|---|
| Nama IUPAC
2,4,6-Trimetil-1,3,5-trioksana
| |
| Nama IUPAC (sistematis)
2,4,6-Trimetil-1,3,5-trioksana | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Nomor EC | |
| KEGG | |
| MeSH | Paraldehyde |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C6H12O3 | |
| Massa molar | 132,16 g·mol−1 |
| Penampilan | Cairan tak berwarna |
| Bau | Manis |
| Densitas | 0,996 g/cm3 |
| Titik lebur | 12 °C (54 °F; 285 K) |
| Titik didih | 124 °C (255 °F; 397 K)[1] |
| larut 10% vv pada 25 Derajat. | |
| Tekanan uap | 13 hPa pada 20 °C[1] |
| -86,2·10−6 cm3/mol | |
| Farmakologi | |
| Kode ATC | N05 |
| Bahaya | |
| Bahaya utama | Mudah terbakar |
| Lembar data keselamatan | [1] |
| Piktogram GHS | 
|
| Keterangan bahaya GHS | {{{value}}} |
| H226 | |
| P210, P233, P303+361+353, P370+378, P403+235, P501 | |
| Titik nyala | 24°C - ditutup |
| Ambang ledakan | Batas atas: 17 %(V) Batas bawah: 1.3 %(V) |
| Dosis atau konsentrasi letal (LD, LC): | |
LD50 (dosis median)
|
Oral - pada tikus - 1,530 mg/kg Dermal - pada kelinci - 14,015 mg/kg |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
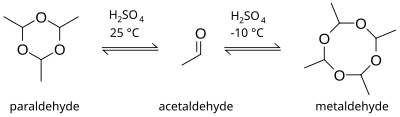
Paraldehida adalah trimer siklik dari molekul asetaldehida.[2] Secara formal senyawa ini adalah turunan dari 1,3,5-trioksan; dengan gugus metil yang menggantikan atom hidrogen pada setiap karbon. Tetramer yang sesuai adalah metaldehida. Cairan tak berwarna ini sedikit larut dalam air dan sangat larut dalam etanol. Paraldehida perlahan teroksidasi di udara, berubah menjadi cokelat dan menghasilkan bau asam asetat. Senyawa ini menyerang sebagian besar plastik dan karet dan harus disimpan dalam botol kaca.
Paraldehida pertama kali diamati pada tahun 1835 oleh ahli kimia Jerman Justus Liebig; rumus empirisnya ditentukan pada tahun 1838 oleh muridnya, Hermann Fehling.[3][4] Kimiawan Jerman Valentin Hermann Weidenbusch (1821–1893), salah satu murid Liebig, mensintesis paraldehida pada tahun 1848 dengan cara mengolah asetaldehida dengan asam (baik asam sulfat maupun asam nitrat) dan mendinginkannya hingga 0°C. Ia menemukan bahwa ketika paraldehida dipanaskan dengan sedikit asam yang sama, reaksinya berlangsung sebaliknya, menghasilkan asetaldehida.[5][6]
Paraldehida memiliki kegunaan dalam industri dan pengobatan.
Preparasi
[sunting | sunting sumber]Paraldehida dapat diproduksi melalui reaksi langsung asetaldehida dan asam sulfat. Produk reaksi bergantung pada suhu. Pada suhu kamar dan lebih tinggi, pembentukan trimer lebih disukai, tetapi pada suhu yang lebih rendah, sekitar −10 °C, tetramer metaldehida lebih mungkin diproduksi.[7]
Reaksi asam sulfat dan asetaldehida bersifat eksotermik, dengan panas reaksi sebesar −113 kJ·mol−1.[8]
Stereokimia
[sunting | sunting sumber]Paraldehida diproduksi dan digunakan sebagai campuran dua diastereomer, yang dikenal sebagai cis- dan trans-paraldehida. Untuk setiap diastereomer, dua konformer kursi dimungkinkan. Struktur (1), (4) dan (2), (3) masing-masing merupakan konformer dari cis- dan trans-paraldehida. Struktur (3) (konformer dari (2)) dan (4) (konformer dari (1)) merupakan konformer berenergi tinggi pada dasar sterik (interaksi 1,3-diaksial hadir) dan tidak ada dalam tingkat yang berarti dalam sampel paraldehida.[9][10]
Reaksi
[sunting | sunting sumber]Dipanaskan dengan sejumlah katalis asam, ia mengalami depolimerisasi kembali menjadi asetaldehida:[11][12]
- C6H12O3 → 3CH3CHO
Karena paraldehida memiliki karakteristik penanganan yang lebih baik, ia dapat digunakan secara tidak langsung atau langsung sebagai padanan sintetis asetaldehida anhidrat (t.p. 20 °C). Misalnya, ia digunakan apa adanya dalam sintesis bromal (tribromoasetaldehida):[13]
- C6H12O3 + 9 Br2 → 3 CBr3CHO + 9 HBr
Kegunaan medis
[sunting | sunting sumber]Paraldehida diperkenalkan ke dalam praktik klinis di Britania Raya oleh dokter Italia Vincenzo Cervello (1854–1918) pada tahun 1882.[14][15][16]
Paraldehida merupakan depresan sistem saraf pusat dan segera ditemukan sebagai antikonvulsan, hipnotik, dan sedatif yang efektif. Paraldehida dimasukkan dalam beberapa obat batuk sebagai ekspektoran (meskipun tidak ada mekanisme yang diketahui untuk fungsi ini selain efek plasebo).
Sebagai obat antisawan
[sunting | sunting sumber]Saat ini, paraldehida terkadang digunakan untuk mengobati status epileptikus. Tidak seperti diazepam dan benzodiazepin lainnya, obat ini tidak menekan pernapasan pada dosis terapeutik dan karenanya lebih aman ketika tidak ada fasilitas resusitasi atau ketika pernapasan pasien sudah terganggu.[17] Hal ini menjadikannya obat darurat yang berguna bagi orang tua dan pengasuh anak-anak penderita epilepsi. Karena margin dosis antara efek antikonvulsan dan hipnotik kecil, pengobatan paraldehida biasanya menghasilkan tidur.
Kegunaan Industri
[sunting | sunting sumber]Paraldehida digunakan dalam pembuatan resin sebagai alternatif formaldehida saat membuat resin fenol formaldehida. Zat ini juga digunakan sebagai bahan pengawet antimikroba, dan jarang digunakan sebagai pelarut. Zat ini telah digunakan dalam pembuatan aldehida fuchsin.[18]
Referensi
[sunting | sunting sumber]- ^ a b c Sigma-Aldrich Co., Paraldehyde.
- ^ Wankhede, N N; Wankhede, D S; Lande, M K; Arbad, B R (March 2006). "Densities and ultrasonic velocities of binary mixtures of 2,4,6-trimethyl-1,3,5-trioxane + n-alcohols at 298.15, 303.15 and 308.15 K" (PDF). Indian Journal of Chemical Technology. 13 (2): 149–155.
- ^ Liebig, Justus (1835) "Ueber die Producte der Oxydation des Alkohols" (On the products of the oxidation of ethanol), Annalen der Chemie, 14 : 133–167; see especially p. 141.
- ^ Fehling, H. (1838) "Ueber zwei dem Aldehyd isomere Verbindungen" (On two compounds that are isomeric to acetaldehyde), Annalen der Chemie, 27 : 319–322; see pp. 321–322.
- ^ Weidenbusch, H. (1848) "Ueber einige Producte der Einwirkung von Alkalien und Säuren auf den Aldehyd" (On some products of the reaction of alkalies and acids with acetaldehyde), Annalen der Chemie, 66 : 152-165; see pp. 155–158.
- ^ Paraldehyde was first synthesized by Weidenbusch in 1848:
- (Editorial staff) (April 15, 1885) "The action of paraldehyde," The Therapeutic Gazette, 9 : 247-250; see p. 247.
- See also: Henry Watts, Matthew Moncrieff Pattison Muir, and Henry Forster Morley, Watts' Dictionary of Chemistry, rev'd, vol. 1 (London, England: Longmans, Green, and Co., 1905), p. 106.
- Neill Busse, Der Meister und seine Schüler: Das Netzwerk Justus Liebigs und seiner Studenten [The Master and His Disciples: The network of Justus Liebig and his students] (Hildesheim, Germany: Georg Olms Verlag, 2015); for Weidenbusch's dates, see p. 274.
- See also: Joseph S. Fruton (March 1988) "The Liebig research group: A reappraisal," Proceedings of the American Philosophical Society, 132 (1) : 1–66; see p. 59.
- See also: Deutsche Biographische Enzyklopädie Diarsipkan 2014-08-11 di Wayback Machine. (German Biographical Encyclopedia), p. 1154.
- ^ Latscha, Hans Peter; Kazmaier, Uli; Klein, Helmut A. (2005). Chemie für Biologen mit 71 Tabellen (dalam bahasa Jerman). Berlin. hlm. 515. ISBN 978-3-540-21161-7. OCLC 76495748.
- ^ Eckert, Marc; Fleischmann, Gerald; Jira, Reinhard; Bolt, Hermann M.; Golka, Klaus (2006-12-15), "Acetaldehyde", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA, doi:10.1002/14356007.a01_031.pub2, ISBN 3527306730
- ^ Kewley, R. (1970). "Microwave spectrum of paraldehyde". Canadian Journal of Chemistry. 48 (5): 852–855. doi:10.1139/v70-136
 .
.
- ^ Carpenter, D. C.; Brockway, L. O. (1936). "The Electron Diffraction Study of Paraldehyde". Journal of the American Chemical Society. 58 (7): 1270–1273. Bibcode:1936JAChS..58.1270C. doi:10.1021/ja01298a053.
- ^ Kendall, E. C. (1941). "dl-Alanine". Org. Synth.; Coll. Vol. 1: 21.
- ^ Nathan L. Drake (1943). "Methyl isopropyl carbinol". Org. Synth.; Coll. Vol. 2: 406.
- ^ F. A. Long. "Bromal". Org. Synth.; Coll. Vol. 2: 87.
- ^ López-Muñoz F, Ucha-Udabe R, Alamo C (December 2005). "The history of barbiturates a century after their clinical introduction". Neuropsychiatric Disease and Treatment. 1 (4): 329–43. PMC 2424120
 . PMID 18568113.
. PMID 18568113.
- ^ See:
- Cervello, Vincenzo (1883) "Sull'azione fisiologica della paraldeide e contributo allo studio del cloralio idrato" (On the physiological action of paraldehyde and contribution to the study of chloral hydrate), Archivio per le Scienze Mediche, 6 (12) : 177–214.
- Cervello, Vincenzo (1884) "Recherches cliniques et physiologiques sur la paraldehyde" (Clinical and physiological investigations into paraldehyde), Archives italiennes de biologie, 6 : 113–134.
- ^ For biographical information about Vencenzo Cervello, see: Dizionario Biografico (in Italian)
- ^ Norris E, Marzouk O, Nunn A, McIntyre J, Choonara I (1999). "Respiratory depression in children receiving diazepam for acute seizures: a prospective study". Dev Med Child Neurol. 41 (5): 340–3. doi:10.1017/S0012162299000742 (tidak aktif 9 December 2024). PMID 10378761.
- ^ Nettleton GS (February 1982). "The role of paraldehyde in the rapid preparation of aldehyde fuchsin". Journal of Histochemistry and Cytochemistry. 30 (2): 175–8. doi:10.1177/30.2.6174561
 . PMID 6174561.
. PMID 6174561.