Ion
Ion[1] adalah suatu atom atau molekul yang memiliki muatan listrik total tidak nol (jumlah total elektron tidak sama dengan jumlah total proton). Kation adalah ion bermuatan positif, sedangkan anion adalah ion bermuatan negatif. Oleh karena itu, sebuah molekul kation memiliki sebuah proton hidrogen tanpa elektron, sedangkan anion memiliki elektron ekstra. Oleh karena muatan listriknya yang berlawanan, kation dan anion saling tertarik satu sama lain dan mudah membentuk senyawa ionik.
Ion yang hanya berisi satu atom disebut ion monoatomik atau ion atomik, sementara yang berisi dua atau lebih atom membentuk ion molekuler atau ion poliatomik. Dalam hal ionisasi fisik dalam suatu media, misalnya gas, "pasangan ion" tercipta dari tumbukan ion, di mana masing-masing pasangan yang terbentuk mengandung elektron bebas dan ion positif.[2] Ion juga tercipta melalui interaksi kimia, misalnya pelarutan garam dalam cairan, atau dengan cara lain, melewatkan arus searah melalui larutan penghantar yang melarutkan anode melalui ionisasi.
Sejarah penemuan ion
[sunting | sunting sumber]Kata ion berasal dari bahasa Yunani: ἰόν, ion, "sedang pergi", kata kerja bentuk sedang dari bahasa Yunani: ἰέναι, ienai, "pergi". Istilah ini diperkenalkan oleh fisikawan dan kimiawan Inggris Michael Faraday pada tahun 1834 untuk menyebut spesies tak dikenal yang pergi dari satu elektrode ke elektrode lain melalui media berair.[3][4] Faraday tidak mengetahui sifat spesies ini, tetapi ia mengetahui bahwa ketika logam larut ke dalam dan memasuki larutan pada satu elektrode, logam baru muncul dari larutan pada elektrode lainnya; zat tersebut telah bergerak melalui larutan dalam suatu arus. Ion ini membawa materi dari satu tempat ke tempat lain.
Faraday juga memperkenalkan kata anion untuk ion bermuatan negatif, dan kation untuk ion bermuatan positif. Dalam tatanama Faraday, kation dinamakan demikian karena mereka tertarik ke katode dalam perangkat galvani dan anion dinamakan demikian karena mereka tertarik ke anode.
Svante Arrhenius mengajukan penjelasannya, pada disertasinya tahun 1884, bahwa faktanya garam kristal padat terdisosiasi menjadi pasangan partikel bermuatan ketika melarut. Disertasinya ini membuat Arrhenius memperoleh Nobel Kimia tahun 1903.[5] Penjelasan Arrhenius adalah bahwa dalam pembentukan larutan, garam terdisosiasi menjadi ion-ion Faraday. Arrhenius mengusulkan bahwa ion terbentuk meskipun tanpa adanya arus listrik.[6][7][8]
Karakteristik
[sunting | sunting sumber]Ion dalam keadaan mirip gasnya bersifat sangat reaktif dan akan cepat berinteraksi dengan ion yang memiliki muatan berlawanan menghasilkan molekul netral atau garam ionik. Ion juga dihasilkan dalam keadaan cair atau padat ketika garam berinteraksi dengan pelarut (misalnya, air) menghasilkan "ion tersolvasi", yang lebih stabil. Ion-ion bergerak saling menjauhi untuk berinteraksi dengan cairan dengan alasan yang melibatkan perubahan energi dan entropi. Spesies yang terstabilkan ini lebih banyak dijumpai di lingkungan bertemperatur rendah. Contoh umum adalah ion yang terdapat dalam air laut, yang berasal dari garam-garam terlarut.
Seluruh ion memiliki muatan, yang berarti, seperti objek-objek bermuatan lainnya, mereka:
- tertarik dengan muatan listrik yang berlawanan (positif kepada negatif dan sebaliknya),
- menolak muatan sejenis
- ketika bergerak, trayektori (lintasan) mereka dapat dibelokkan oleh medan magnet.
Elektron, karena massanya yang kecil sehingga sifat menempati ruangnya yang besar dianggap sebagai gelombang materi (bahasa Inggris: matter wave). Ini menentukan seluruh ukuran atom dan molekul yang memiliki elektron. Anion (ion bermuatan negatif) lebih besar daripada molekul atau atom induknya, karena kelebihan elektron saling tolak-menolak satu sama lain sehingga menambah ukuran fisik ion, dan ukurannya ditentukan oleh awan elektronnya. Dengan demikian, secara umum, kation berukuran lebih kecil daripada atom atau molekul induknya karena ukuran awan elektronnya juga lebih kecil. Kation hidrogen tidak memiliki elektron sama sekali, sehingga hanya memiliki proton tunggal - jauh lebih kecil daripada atom hidrogen.
Anion dan kation
[sunting | sunting sumber]
Oleh karena muatan listrik pada proton secara besaran adalah sama dengan muatan elektron, muatan listrik netto suatu ion adalah sama dengan jumlah proton dalam ion dikurangi jumlah elektron.
Anion (−), berasal dari bahasa Yunani: ἄνω (ánō), yang berarti "naik",[9] adalah ion dengan jumlah elektron lebih banyak daripada proton, menghasilkan muatan netto negatif (karena elektron bermuatan negatif dan proton bermuatan positif).[10]
Kation (+), berasal dari bahasa Yunani: κάτω (káto), yang berarti "turun",[11] adalah ion dengan jumlah elektron lebih sedikit daripada proton, memberikan muatan positif.[12]
Terdapat dua nama tambahan yang digunakan untuk ion dengan muatan banyak. Misalnya, ion dengan muatan −2 dikenal sebagai dianion dan ion dengan muatan +2 dikenal sebagai dikation. Ion zwitter adalah molekul netral dengan muatan positif dan negatif di beberapa tempat yang berbeda dalam molekul tersebut.[13]
Kation dan anion ditentukan berdasarkan jari-jari ion dan keduanya memiliki ukuran yang relatif berbeda: "Kation berukuran kecil, sebagian besar memiliki jari-jari kurang dari 10−10 m (10−8 cm). Sebaliknya, sebagian besar anion berukuran besar, seperti anion bumi yang paling umum, oksigen. Berdasarkan fakta ini, tampak bahwa sebagian besar ruang pada kristal ditempati oleh anion dan bahwa kation termuat di dalam ruang-ruang di antaranya."[14]
Sebuah kation memiliki jari-jari kurang dari 0,8 × 10−10 m (0,8 Å) sementara anion memiliki jari-jari yang lebih dari 1,3 × 10−10 m (1,3 Å).[15]
Keterjadian alami
[sunting | sunting sumber]Ion di alam ada di mana-mana dan bertanggung jawab untuk beragam fenomena dari pendaran Matahari hingga keberadaan ionosfer Bumi. Atom dalam keadaan ioniknya dapat memiliki warna yang berbeda dari atom netral, dan dengan demikian penyerapan cahaya oleh ion logam memberikan warna batu permata. Dalam kimia organik maupun anorganik (termasuk biokimia), interaksi air dan ion sangatlah penting; contohnya adalah energi yang mendorong gangguan adenosin trifosfat (ATP). Bagian berikut menjelaskan konteks di mana fitur ion menonjol; dan disusun sesuai penurunan skala panjang fisik, dari astronomis ke mikroskopis.
Teknologi terkait
[sunting | sunting sumber]Ion dapat disiapkan secara non-kimia menggunakan berbagai sumber ion, biasanya melibatkan tegangan tinggi atau suhu. Ion digunakan dalam banyak perangkat seperti spektrometer massa, spektrometer emisi optik, akselerator partikel, implanter ion, dan mesin ion.
Sebagai partikel bermuatan yang reaktif, mereka juga digunakan dalam pemurnian udara dengan cara mengganggu mikrob, dan pada peralatan rumah tangga seperti detektor asap.
Oleh karena pensinyalan dan metabolisme dalam organisme dikendalikan oleh gradien ionik yang tepat melintasi membran, gangguan gradien ini berkontribusi terhadap kematian sel. Ini adalah mekanisme umum yang dieksploitasi oleh biosida alami dan buatan, termasuk saluran ion gramisidina dan amfoterisin (fungisida).
Ion anorganik terlarut adalah komponen dari padatan terlarut total, indikator kualitas air yang dikenal luas.
Deteksi radiasi pengion
[sunting | sunting sumber]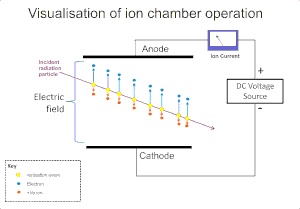
Efek pengion radiasi pada gas banyak digunakan untuk mendeteksi radiasi seperti partikel alfa, beta, sinar gama dan sinar-X. Kejadian ionisasi awalnya pada instrumen ini menghasilkan pembentukan suatu "pasangan ion"; ion positif dan elektron bebas, melalui tumbukan ion oleh radiasi pada molekul gas. Bejana ionisasi adalah bentuk paling sederhana detektor ini, dan mengumpulkan semua muatan yang terbentuk melalui ionisasi langsung di dalam gas yang diaplikasikan melalui medan listrik.[2]
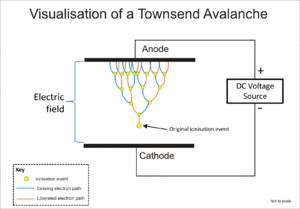
Tabung Geiger-Müller dan pencacah proporsional keduanya menggunakan fenomena yang dikenal sebagai longsoran Townsend (bahasa Inggris: Townsend discharge) untuk melipatgandakan efek dari peristiwa pengion asli dengan menggunakan efek air terjun di mana elektron bebas diberikan energi yang cukup oleh medan listrik untuk melepaskan elektron lebih lanjut melalui tumbukan ion.
Kimia
[sunting | sunting sumber]Notasi
[sunting | sunting sumber]Penulisan muatan
[sunting | sunting sumber]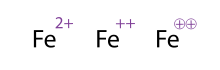
Ketika menulis rumus kimia sebuah ion, muatan nettonya ditulis sebagai superskrip di belakang struktur kimia molekul/atom. Jika muatan netto lebih dari 1, maka nilainya ditulis sebelum tanda; yaitu, untuk kation bermuatan ganda ditulis sebagai 2+ dan bukan +2. Untuk muatan tunggal, nilainya tidak perlu ditulis, misalnya kation natrium ditulis sebagai Na+ dan bukan bukan Na1+.
Cara alternatif (dan dapat diterima) untuk menunjukkan molekul/atom dengan muatan banyak adalah dengan menuliskan tandanya beberapa kali, ini sering terlihat pada logam transisi. Kimiawan kadang-kadang melingkari tanda muatannya; ini semata-mata kosmetik dan tidak memberikan makna kimia apa-apa. Ketiga penulisan Fe2+ yang ditunjukkan pada gambar adalah ekivalen.
Ion monoatomik kadang-kadang ditulis dengan angka Romawi; misalnya, Fe2+ kadang-kadang ditulis sebagai Fe(II) atau FeII. Bilangan Romawi menunjukkan keadaan oksidasi formal suatu unsur, sementara angka superskrip menunjukkan muatan bersih atau muatan netto. Bagaimanapun, kedua notasi tersebut untuk ion monoatomik adalah sama, tetapi angka Romawi tidak dapat digunakan untuk ion poliatomik. Namun, dimungkinkan untuk mencampur notasi untuk pusat logam dengan kompleks poliatomik, seperti ditunjukkan dalam contoh ion uranil.

Sub-klas
[sunting | sunting sumber]Jika suatu ion mengandung elektron bebas, ia disebut ion radikal. Seperti radikal tak bermuatan, ion radikal sangat reaktif. Ion poliatomik yang mengandung oksigen, seperti karbonat dan sulfat, disebut oksianion (oxyanion). Ion molekular yang mengandung sekurang-kurangnya satu ikatan karbon-hidrogen disebut ion organik. Jika muatan dalam ion organik secara formal terpusat pada suatu karbon, maka ia disebut karbokation (jika bermuatan positif) atau karbanion (jika bermuatan negatif).
Pembentukan
[sunting | sunting sumber]Pembentukan ion monoatomik
[sunting | sunting sumber]Ion monoatomik terbentuk karena atom memperoleh atau kehilangan elektron pada kelopak valensinya (kulit elektron paling luar). Cangkang bagian dalam atom diisi dengan elektron yang terikat erat dengan inti atom yang bermuatan positif, sehingga tidak berpartisipasi dalam interaksi kimia seperti ini. Proses mendapatkan atau kehilangan elektron dari atom atau molekul netral disebut ionisasi.
Atom dapat terionisasi dengan bombardir menggunakan radiasi, tetapi proses ionisasi yang lebih umum dalam ilmu kimia adalah perpindahan elektron antar atom atau molekul. Perpindahan ini biasanya dipicu oleh pembentukan konfigurasi elektron yang stabil ("cangkang tertutup"). Atom akan menerima atau melepas elektron tergantung aksi mana yang energinya lebih rendah.
Sebagai contoh, sebuah atom natrium, Na, memiliki sebuah elektron pada kelopak valensinya, mengitari 2 kelopak stabil yan masing-masing berisi 2 dan 8 elektron. Oleh karena kelopak yang terisi penuh ini sangat stabil, maka atom natrium cenderung kehilangan kelebihan elektronnya dan memperoleh konfigurasi stabil, menjadi kation natrium melalui proses
- Na → Na+ + e−
Sebaliknya, sebuah atom klorin, Cl, memiliki 7 elektron pada kelopak valensinya, hanya kekurangan satu elektron untuk terisi penuh 8 elektron dan menjadi stabil. Oleh karena itu, atom klorin cenderung menerima kelebihan elektron dan memperoleh konfigurasi stabil 8 elektron, menjadi anion klorida melalui proses:
- Cl + e− → Cl−
Kecenderungan ini yang menyebabkan natrium dan klorin mengalami reaksi kimia, yang mana "kelebihan" elektron dipindahkan dari natrium ke klorin, membentuk kation natrium dan anion klorida. Dengan muatan yang berlawanan, kation dan anion ini membentuk ikatan ionik dan bergabung untuk membentuk natrium klorida, NaCl, yang lebih umum dikenal sebagai garam dapur.
- Na+ + Cl− → NaCl
Pembentukan ion poliatomik dan molekular
[sunting | sunting sumber]
Ion poliatomik dan molekular sering kali terbentuk karena menerima atau kehilangan ion elemental seperti proton, H+, dalam molekul netral. Sebagai contoh, ketika amonia, NH3, menerima proton, H+—suatu proses yang disebut protonasi—ia membentuk ion amonium, NH+4. Amonia dan amonium memiliki jumlah elektron yang sama, begitu pula konfigurasi elektronnya, tetapi amonium memiliki kelebihan proton yang menjadikannya bermuatan positif.
Amonia dapat juga kehilangan sebuah elektron sehingga bermuatan positif, membentuk ion NH•+3. Namun, ion ini tidak stabil, karena memiliki kelopak valensi yang tidak lengkap di sekeliling atom nitrogen, sehingga membuatnya menjadi ion radikal yang sangat reaktif.
Mengingat ion radikal tidak stabil, ion poliatomik dan molekular biasanya terbentuk melalui penangkapan atau pelepasan ion elemental seperti H+, dan bukannya menangkap atau melepas elektron. Hal ini memungkinkan molekul memiliki konfigurasi elektron yang stabil meskipun muatan listriknya berubah.
Potensial ionisasi
[sunting | sunting sumber]Energi yang dibutuhkan untuk melepaskan sebuah elektron pada tingkat energi terendahnya dari suatu atom atau molekul gas dengan muatan listrik paling sedikit disebut potensial ionisasi, atau energi ionisasi. Energi ionisasi ke n suatu atom adalah energi yang diperlukan untuk membebaskan elektron ke n setelah elektron n − 1 pertama telah dilepaskan.
Setiap energi ionisasi yang berturut-turut lebih besar daripada yang terakhir. Kenaikan yang sangat besar terjadi setelah blok orbital atom apapun kehabisan elektron. Berdasarkan alasan ini, ion cenderung terbentuk dengan cara yang meninggalkan blok dengan orbital penuh. Misalnya, natrium memiliki satu elektron valensi pada kelopak terluarnya, sehingga bentuk terionisasi biasanya dijumpai dengan kehilangan satu elektron, sebagai Na+. Di sisi lain tabel periodik, klorin memiliki tujuh elektron valensi, sehingga dalam bentuk terionisasi biasanya dijumpai dengan kelebihan satu elektron, sebagai Cl−. Sesium memiliki energi ionisasi terendah dari semua unsur sementara helium yang tertinggi.[16] Secara umum, energi ionisasi logam jauh lebih rendah daripada energi ionisasi nonlogam, sehingga, secara umum, logam akan kehilangan elektron membentuk ion bermuatan positif, sementara nonlogam akan memperoleh elektron membentuk ion bermuatan negatif.
Ikatan ionik
[sunting | sunting sumber]Ikatan ionik adalah suatu ikatan kimia yang muncul dari tarik menarik antara ion-ion yang bermuatan berlawanan. Ion dengan muatan sejenis saling tolak menolak, sedangkan yang bermuatan berlawanan saling tarik menarik. Oleh karena itu, ion biasanya tidak berdiri sendiri, tapi terikat dengan ion yang bermuatan berlawanan membentuk kisi kristal. Senyawa yang terbentuk disebut senyawa ionik, dan terikat oleh ikatan ionik. Dalam senyawa ionik terdapat jarak karakteristik antara ion-ion yang bertetangga, yang merupakan sumber penentuan ekstensi spasial dan jari-jari ion ion individu.
Jenis ikatan ionik yang paling umum terlihat pada senyawa logam dan nonlogam (kecuali gas mulia, yang jarang membentuk senyawa kimia). Logam dikarakterisasi dengan memiliki sejumlah kecil elektron yang melebihi konfigurasi elektronik kelopak tertutup yang stabil. Dengan demikian, mereka memiliki kecenderungan kehilangan elektron ekstra ini untuk mencapai konfigurasi yang stabil. Sifat ini dikenal sebagai elektropositivitas. Nonlogam, sebaliknya, dicirikan memiliki konfigurasi elektron kekurangan sedikit elektron untuk mencapai konfigurasi stabil. Oleh karena itu, mereka memiliki kecenderungan untuk menarik elektron untuk mencapai konfigurasi stabil. Kecenderungan ini dikenal sebagai elektronegativitas. Ketika logam yang sangat elektropositif digabungkan dengan nonlogam yang sangat elektronegatif, kelebihan elektron dari atom logam dipindahkan ke atom logam yang kekurangan elektron. Reaksi ini menghasilkan kation logam dan anion nonlogam, yang saling tertarik satu sama lain membentuk garam.
Ion-ion umum
[sunting | sunting sumber]
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Lihat juga
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ "Ion" entry in Collins English Dictionary.
- ^ a b c Knoll, Glenn F (1999). Radiation detection and measurement (edisi ke-3rd). New York: Wiley. ISBN 0-471-07338-5.
- ^ Michael Faraday (1791-1867). UK: BBC.
- ^ "Online etymology dictionary". Diakses tanggal 2011-01-07.
- ^ "The Nobel Prize in Chemistry 1903". www.nobelprize.org.
- ^ Harris, William; Levey, Judith, ed. (1975). The New Columbia Encyclopedia (edisi ke-4th). New York City: Columbia University. hlm. 155. ISBN 0-231035-721.
- ^ McHenry, Charles, ed. (1992). The New Encyclopædia Britannica. 1 (edisi ke-15). Chicago: Encyclopædia Britannica, Inc. hlm. 587. ISBN 085-229553-7.
- ^ Cillispie, Charles, ed. (1970). Dictionary of Scientific Biography (edisi ke-1). New York City: Charles Scribner's Sons. hlm. 296–302. ISBN 0-684101-122.
- ^ Oxford University Press (2013). "Oxford Reference: OVERVIEW anion". oxfordreference.com.
- ^ University of Colorado Boulder (November 21, 2013). "Atoms and Elements, Isotopes and Ions". colorado.edu.
- ^ Oxford University Press (2013). "Oxford Reference: OVERVIEW cation". oxfordreference.com.
- ^ Douglas W. Haywick, Ph.D.; University of South Alabama (2007–2008). "Elemental Chemistry" (PDF). usouthal.edu.
- ^ Purdue University (November 21, 2013). "Amino Acids". purdue.edu.
- ^ Frank Press & Raymond Siever (1986) Earth, 14th edition, page 63, W. H. Freeman and Company ISBN 0-7167-1743-3
- ^ Linus Pauling (1960) Nature of the Chemical Bond, hlm. 544, pada Google Books
- ^ Chemical elements listed by ionization energy. Lenntech.com
- ^ a b c "Common Ions and Their Charges" (PDF).

