Kalium disianoaurat

| |
| Nama | |
|---|---|
| Nama IUPAC
Kalium disianoaurat(I)
| |
| Nama lain | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Referensi Beilstein | 6235525 |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
| Referensi Gmelin | 37363 |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
| Nomor UN | 1588 |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| KAu(CN)2 | |
| Massa molar | 288,101 g/mol |
| Penampilan | kristal putih[1] |
| Densitas | 3,45 g/cm3[1] |
| Titik didih | terurai |
| 140 g/L[1] | |
| Struktur | |
| Rombohedron, hR54, No. 148 | |
| R3 | |
a = 0,728 nm, b = 0,728 nm, c = 2,636 nm
| |
Volum kisi (V)
|
1,2099 nm3 |
Satuan formula (Z)
|
9 |
| Bahaya | |
| Bahaya utama | beracun |
| Piktogram GHS |   
|
| Keterangan bahaya GHS | {{{value}}} |
| H290, H300, H310, H315, H317, H318, H330, H410 | |
| P260, P264, P273, P280, P284, P301+310 | |
| Senyawa terkait | |
Anion lain
|
Kalium argentosianida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Kalium disianoaurat adalah sebuah senyawa anorganik dengan rumus K[Au(CN)2]. Ia adalah padatan tidak berwarna hingga putih yang larut dalam air dan sedikit larut dalam alkohol. Garam itu sendiri seringkali tidak diisolasi, tetapi larutan ion disianoaurat ([Au(CN)2]−) dihasilkan dalam skala besar dalam ekstraksi emas dari bijihnya.[3]
Produksi
[sunting | sunting sumber]Dalam penambangan emas dari sumber encer, emas diekstraksi secara selektif melalui disolusi dalam larutan sianida berair, disediakan dengan melarutkan natrium sianida, kalium sianida dan/atau kalsium sianida. Reaksi untuk disolusi emas, "Persamaan Elsner", adalah:
- 4 Au + 8 KCN + O2 + 2 H2O → 4 K[Au(CN)2] + 4 KOH
Dalam proses ini, oksigen adalah oksidannya.[4]
Ia juga dapat dihasilkan melalui reaksi garam emas(I) dengan kelebihan kalium sianida.
- AuCl + 2 KCN → K[Au(CN)2] + KCl
Struktur
[sunting | sunting sumber]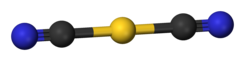
Disianoaurat adalah anion berbentuk batang.
Kalium disianoaurat adalah sebuah garam. Anion disianoaurat adalah linear menurut kristalografi sinar-X.[3] Berdasarkan spektroskopi inframerah, anion disianoaurat mengadopsi struktur yang sangat mirip dengan natrium disianoaurat (NaAu(CN)2).[5]
Kegunaan
[sunting | sunting sumber]Disianoaurat adalah spesies larut yang menjadi fokus sianidasi emas, proses hidrometalurgi untuk memisahkan emas dari bijih encer. Faktanya, natrium sianida, bukan garam kalium sianida, lebih banyak digunakan dalam proses komersial.[6]
Selain penggunaan utamanya sebagai perantara dalam ekstraksi emas, kalium disianoaurat sering digunakan dalam aplikasi penyepuhan emas.
Senyawa terkait
[sunting | sunting sumber]Senyawa yang mengandung emas(III) sianida juga telah dikenal: kalium tetrasianoaurat(III), K[Au(CN)4]. Penggunaannya kurang umum.
Ion kalium dapat diganti dengan kation amonium kuaterner seperti pada tetrabutilamonium disianoaurat.[7]
Keamanan
[sunting | sunting sumber]Menelan kalium disianoaurat dalam jumlah beberapa gram dapat menyebabkan kematian.[8]
Referensi
[sunting | sunting sumber]- ^ a b c d Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (edisi ke-92). CRC Press. hlm. 4.82. ISBN 978-1439855119.
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (Edisi ke-2), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ a b Rosenzweig, A.; Cromer, D. T. (1959). "The Crystal Structure of KAu(CN)2". Acta Crystallographica. 12 (10): 709–712. doi:10.1107/S0365110X59002109.
- ^ Treatment of Ores Containing Reactive Iron Sulphides. Multi Mix Systems
- ^ Chadwick, B.M.; Frankiss, S.G. (1976). "Vibrational Spectra and Structures of Some Dicyanoaurate(I) Complexes". Journal of Molecular Structure. 31 (1): 1–9. Bibcode:1976JMoSt..31....1C. doi:10.1016/0022-2860(76)80113-5.
- ^ Rubo, Andreas; Kellens, Raf; Reddy, Jay; Steier, Norbert; Hasenpusch, Wolfgang (2005), "Alkali Metal Cyanides", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.i01_i01
- ^ Stender, Matthias; Olmstead, Marilyn M.; Balch, Alan L.; Rios, Daniel; Attar, Saeed (2003). "Cation and Hydrogen Bonding Effects on the Self-Association and Luminescence of the Dicyanoaurate Ion, Au(CN)2−". Dalton Transactions (22): 4282. doi:10.1039/b310085e.
- ^ Wright, I. H.; Vesey, C. J. (September 1986). "Acute poisoning with gold cyanide". Anaesthesia. 41 (9): 936–939. doi:10.1111/j.1365-2044.1986.tb12920.x
 . PMID 3022615.
. PMID 3022615.

