Perak(I) fluorida

| |
| |
| Nama | |
|---|---|
| Nama IUPAC
Perak(I) fluorida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| Sifat | |
| AgF | |
| Massa molar | 126,87 g·mol−1 |
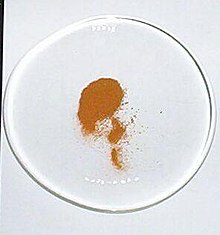
| Penampilan | Padat kuning-coklat |
| Densitas | 5.852 g/cm3 (15 °C) |
| Titik lebur | 435 °C (815 °F; 708 K) |
| Titik didih | 1.159 °C (2.118 °F; 1.432 K) |
| 85.78 g/100 mL (0 °C) 119.8 g/100 mL (10 °C) 179.1 g/100 mL (25 °C) 213.4 g/100 mL (50 °C)[1] | |
| Kelarutan | 83g/100 g (11.9 °C) dalam hidrogen fluorida 1.5g/100 mL dalam metanol(25 °C)[2] |
| −36.5·10−6 cm3/mol | |
| Struktur | |
| Kubik | |
| Termokimia | |
| Kapasitas kalor (C) | 48.1 J/mol·K[1] |
| Entropi molar standar (S |
83.7 J/mol·K[1] |
| Entalpi pembentukan standar (ΔfH |
-206 kJ/mol[1] |
| Energi bebas Gibbs (ΔfG) | -187.9 kJ/mol[1] |
| Bahaya | |
| Bahaya utama | Korosif |
| Piktogram GHS |  [3] [3]
|
| Keterangan bahaya GHS | {{{value}}} |
| H314 | |
| P280, P305+351+338, P310 | |
| Senyawa terkait | |
Anion lain
|
Perak(I) oksida Perak(I) klorida |
Kation lainnya
|
Tembaga(I) fluorida Emas(I) fluorida |
Senyawa terkait
|
Perak subfluorida Perak(II) fluoridPerak(I) fluorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Perak(I) fluorida adalah senyawa anorganik dengan rumus AgF. Senyawa ini merupakan salah satu tiga jenis senyawa perak fluorida: senyawa perak fluorida lainnya adalah perak subfluorida dan perak(II) fluorida. AgF telah digunakan sebagai reagen fluorinasi dan desililasi dalam proses sintesis organik.
Pembuatan
[sunting | sunting sumber]Perak(I) fluorida dengan tingkat kemurnian yang tinggi dapat dibuat dengan memanaskan perak karbonat hingga mencapai suhu 310 °C di tengah keberadaan hidrogen fluorida di dalam sebuah tabung platinum:[4]
- Ag2CO3 + 2HF → 2AgF + H2O + CO2
Di laboratorium, gas hidrogen fluorida biasanya tidak digunakan. Metode yang digunakan adalah dengan memanaskan dan mendekomposisi perak tetrafluoroborat:
- AgBF4 → AgF + BF3
Cara lain adalah dengan melarutkan perak(I) oksida di dalam larutan asam florida yang terkonsentrasi:[4]
- Ag2O + 2HF → 2 AgF + H2O
Catatan kaki
[sunting | sunting sumber]- ^ a b c d e Chemister Chemical Database, Kiper Ruslan Anatolievich, 2002-15. URL: http://chemister.ru/Database/properties-en.php?dbid=1&id=1067
- ^ Busse, Juliette K.; Stoner, Eric J. (2001). "Silver (I) fluoride". e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002/047084289X.rs016.
- ^ Sigma-Aldrich Co., Silver(I) fluoride. Diakses tanggal 2014-05-08.
- ^ a b Roesky, Herbert W. (2012). Efficient Preparation of Fluorine Compounds. Somerset, New Jersey: Wiley. ISBN 9781118409428.
