Piranosa
Dalam kimia organik, piranosa adalah istilah kolektif untuk sakarida yang memiliki struktur kimia yang mencakup cincin beranggota enam, yang terdiri dari lima atom karbon dan satu atom oksigen (senyawa heterosiklik). Mungkin ada karbon lain di luar cincin. Nama ini diambil dari kemiripannya dengan piran oksigen heterosiklik, tetapi cincin piranosa tidak memiliki ikatan ganda. Piranosa yang anomeriknya −OH (gugus hidroksil) di C(l) telah diubah menjadi gugus OR disebut piranosida.
| Tetrahidropiran | |||
| Nama | Tetrahidropiran | α-D-(+)-Glukopiranosa | |
| Rumus struktur |  |

| |
| Cincin tetrahidropiran disorot dengan warna biru | Cincin tetrahidropiran disorot dengan warna biru | ||
Sejarah
[sunting | sunting sumber]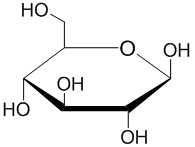
Hermann Emil Fischer memenangkan Penghargaan Nobel Kimia (1902) atas karyanya dalam menentukan struktur D-aldoheksosa.[1] Namun, struktur linier aldehid bebas yang diusulkan Fischer mewakili persentase yang sangat kecil dari bentuk gula heksosa dalam larutan. Edmund Hirst dan Clifford Purves dalam kelompok penelitian Norman Haworth, yang secara meyakinkan menetapkan bahwa gula heksosa lebih disukai membentuk cincin piranosa, atau beranggota enam. Haworth menggambar cincin itu sebagai segi enam datar dengan kelompok di atas dan di bawah bidang cincin (proyeksi Haworth).[2]
Penyempurnaan lebih lanjut terhadap konformasi cincin piranosa terjadi ketika Sponsler dan Dore (1926) menyadari bahwa perlakuan matematis Sachse terhadap cincin beranggota enam dapat diterapkan pada struktur selulosa sinar-X. Ditentukan bahwa cincin piranosa berkerut, untuk memungkinkan semua atom karbon pada cincin tersebut mendekati geometri tetrahedral yang ideal.
Formasi
[sunting | sunting sumber]Cincin piranosa dibentuk oleh reaksi gugus hidroksil pada karbon 5 (C-5) gula dengan aldehid pada karbon 1. Ini membentuk hemiasetal intramolekul. Jika reaksi terjadi antara hidroksil C-4 dan aldehida, maka akan terbentuk furanosa.[1] Bentuk piranosa secara termodinamika lebih stabil dibandingkan bentuk furanosa, yang terlihat dari sebaran kedua bentuk siklik tersebut dalam larutan.[3]

Konformasi
[sunting | sunting sumber]Kerutan ini menghasilkan total 38 isomerisme konformasi piranosa dasar yang berbeda: 2 kursi, 6 perahu, 6 perahu miring, 12 kursi setengah, dan 12 amplop.[4]

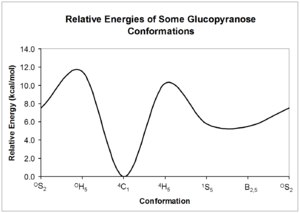
Para konformer ini dapat saling berkonversi satu sama lain; namun, setiap bentuk mungkin memiliki energi relatif yang sangat berbeda, sehingga mungkin terdapat hambatan yang signifikan terhadap interkonversi. Energi konformasi ini dapat dihitung dari mekanika kuantum; contoh kemungkinan interkonversi glukopiranosa diberikan.[5]
Konformasi cincin piranosa secara dangkal mirip dengan konformasi cincin sikloheksana. Namun, tata nama spesifik piranosa mencakup referensi ke oksigen cincin, dan keberadaan hidroksil pada cincin mempunyai efek berbeda pada preferensi konformasinya. Ada juga efek konformasi dan stereokimia khusus untuk cincin piranosa.
Tata Nama
[sunting | sunting sumber]
Untuk memberi nama konformasi piranosa, terlebih dahulu ditentukan konformernya. Konformer yang umum serupa dengan yang ditemukan pada sikloheksana, dan inilah yang mendasari namanya. Konformasi yang umum adalah kursi (C), perahu (B), miring (S), setengah kursi (H) atau amplop (E). Atom cincin kemudian diberi nomor; karbon anomerik, atau hemiasetal, selalu 1. Atom oksigen dalam struktur, secara umum, disebut dengan atom karbon tempat mereka terikat dalam bentuk asiklik, dan diberi nama O. Maka:
- Posisikan cincin sedemikian rupa sehingga jika dilihat dari sisi atas, atom diberi nomor searah jarum jam.
- Pada konformasi kursi dan kemiringan, bidang referensi harus dipilih. Pada konformasi kursi, bidang acuan dipilih sedemikian rupa sehingga atom dengan nomor terendah (biasanya C-1) adalah eksoplanar. Pada konformasi miring, bidang tersebut berisi tiga atom yang berdekatan dan satu atom lainnya dengan atom dengan jumlah eksoplanar serendah mungkin.[6]
- Atom-atom yang berada di atas bidang ditulis sebelum label konformer, sebagai superskrip
- Atom-atom yang berada di bawah bidang ditulis mengikuti label konformer, sebagai subskrip[7]
Spektroskopi NMR
[sunting | sunting sumber]Seperti yang ditunjukkan oleh energi struktur relatif pada diagram di atas, struktur kursi merupakan bentuk karbohidrat paling stabil. Konformasi yang relatif jelas dan stabil ini berarti bahwa atom hidrogen pada cincin piranosa berada pada sudut yang relatif konstan satu sama lain. NMR karbohidrat memanfaatkan sudut dihedral ini untuk menentukan konfigurasi masing-masing gugus hidroksil di sekitar cincin.
Referensi
[sunting | sunting sumber]- ^ a b Robyt, J.F. (1998). Essentials of Carbohydrate Chemistry. Springer. ISBN 0-387-94951-8.
- ^ Rao, V.S.R.; Qasba, P.K.; Chandrasekaran, R.; Balaji, P.V. (1998). Conformation of Carbohydrates. CRC Press. ISBN 90-5702-315-6.
- ^ Ma, B.Y.; Schaefer, H.F.; Allinger, N.L. (1998). "Theoretical studies of the potential energy surfaces and compositions of the D-aldo and D-ketohexoses". Journal of the American Chemical Society. 120 (14): 3411–3422. doi:10.1021/ja9713439.
- ^ Ionescu, A.R.; Berces, A.; Zgierski, M.Z.; Whitfield, D.M.; Nukada, T. (2005). "Conformational Pathways of Saturated Six-Membered Rings. A Static and Dynamical Density Functional Study". The Journal of Physical Chemistry A. 109 (36): 8096–8105. Bibcode:2005JPCA..109.8096I. doi:10.1021/jp052197t. PMID 16834195.
- ^ Biarns, X.; Ardvol, A.; Planas, A.; Rovira, C.; Laio, A.; Parrinello, M. (2007). "The Conformational Free Energy Landscape of β-D-Glucopyranose. Implications for Substrate Preactivation in β-Glucoside Hydrolases". Journal of the American Chemical Society. 129 (35): 10686–10693. doi:10.1021/ja068411o. PMID 17696342.
- ^ Grindley, T. Bruce (2008). "Structure and Conformation of Carbohydrates". Dalam Fraser-Reid, B.O.; Tatsuta, K.; Thiem, J.; Coté, G.L.; Flitsch, S.; Ito, Y.; Kondo, H.; Nishimura, S.-i.; Yu, B. Glycoscience: Chemistry and Chemical Biology I–III. hlm. 3–55. doi:10.1007/978-3-540-30429-6_1. ISBN 978-3-540-30429-6.
- ^ Furhop, J.H.; Endisch, C. (2000). Molecular and Supramolecular Chemistry of Natural Products and Their Model Compounds. CRC Press. ISBN 0-8247-8201-1.
