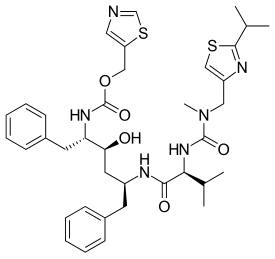
Ritonavir
| |
|---|---|

| |
| Nama sistematis (IUPAC) | |
| 1,3-tiazol-5-ilmetil N-[(2S,3S,5S)-3-hidroksi-5-[(2S)-3-metil-2-{[metil({[2-(propan-2-il)-1,3-tiazol-4-il]metil})karbamoil]amino}butanamido]-1,6-difenilheksan-2-il]karbamat | |
| Data klinis | |
| Nama dagang | Norvir |
| AHFS/Drugs.com | monograph |
| MedlinePlus | a696029 |
| Data lisensi | EMA:pranala, US Daily Med:pranala |
| Kat. kehamilan | B3(AU) |
| Status hukum | Harus dengan resep dokter (S4) (AU) ℞-only (CA) POM (UK) ℞-only (US) |
| Rute | Oral |
| Data farmakokinetik | |
| Ikatan protein | 98–99% |
| Metabolisme | Hati, CYP3A4 |
| Waktu paruh | 3–4 jam[1][2] |
| Ekskresi | Kebanyakan feses |
| Pengenal | |
| Nomor CAS | 155213-67-5 |
| Kode ATC | J05AE03 |
| PubChem | CID 392622 |
| DrugBank | DB00503 |
| ChemSpider | 347980 |
| UNII | O3J8G9O825 |
| KEGG | D00427 |
| ChEBI | CHEBI:45409 |
| ChEMBL | CHEMBL163 |
| NIAID ChemDB | AIDSNO:028478 |
| Sinonim | RTV |
| Data kimia | |
| Rumus | C37H48N6O5S2 |
| |
Ritonavir adalah obat antiretroviral yang digunakan bersama dengan obat lain untuk mengobati HIV/AIDS.[3][4][5] Pengobatan kombinasi ini dikenal sebagai terapi antiretroviral yang sangat aktif (HAART).[5] Ritonavir adalah penghambat protease, meskipun sekarang obat ini terutama berfungsi untuk meningkatkan potensi penghambat protease lainnya.[5][6] Obat ini juga dapat digunakan dalam kombinasi dengan obat lain untuk mengobati hepatitis C dan COVID-19.[7][8] Obat ini digunakan dengan cara diminum.[5]
Efek samping umum ritonavir meliputi mual, muntah, kehilangan nafsu makan, diare, serta mati rasa pada tangan dan kaki. Efek samping serius meliputi komplikasi hati, pankreatitis, reaksi alergi, dan aritmia. Interaksi serius dapat terjadi dengan sejumlah obat lain termasuk amiodaron dan simvastatin.[5] Pada dosis rendah, obat ini dianggap dapat diterima untuk digunakan selama kehamilan.[9] Ritonavir termasuk golongan penghambat protease.[5] Namun, obat ini juga umum digunakan untuk menghambat enzim yang memetabolisme penghambat protease lainnya. Penghambatan ini memungkinkan penggunaan dosis yang lebih rendah.[10]
Ritonavir dipatenkan pada tahun 1989 dan mulai digunakan dalam dunia medis pada tahun 1996.[11][12] Obat ini tercantum dalam Daftar Obat Esensial Organisasi Kesehatan Dunia.[13][14]
Sejarah
[sunting | sunting sumber]
Ritonavir dijual sebagai Norvir oleh AbbVie, Inc.[3][4] Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) menyetujui ritonavir pada tanggal 1 Maret 1996,[16][17] Sebagai hasil dari pengenalan "terapi antiretroviral yang sangat aktif", tingkat kematian tahunan terkait HIV di AS turun dari lebih dari 50.000 menjadi sekitar 18.000 selama periode dua tahun.[15]
Pada tahun 2014, FDA menyetujui kombinasi ombitasvir/paritaprevir/ritonavir untuk pengobatan virus hepatitis C (HCV) genotipe 4.[7]
Setelah dimulainya pandemi COVID pada tahun 2020, banyak antivirus termasuk penghambat protease secara umum dan ritonavir secara khusus, digunakan kembali dalam upaya untuk mengobati infeksi baru tersebut. Lopinavir/ritonavir ditemukan tidak bekerja pada COVID-19 yang parah.[18] Skrining virtual yang diikuti oleh analisis dinamika molekuler memperkirakan ritonavir menghambat pengikatan protein spike (S) SARS-CoV-2 ke reseptor enzim pengubah angiotensin 2 (hACE2) manusia, yang sangat penting untuk masuknya virus ke dalam sel manusia.[19]
Akhirnya pada tahun 2021, kombinasi ritonavir dengan nirmatrelvir, penghambat protease mirip 3C yang baru dikembangkan untuk pengobatan COVID-19.[20][21][22][23] Ritonavir berfungsi untuk memperlambat metabolisme nirmatrelvir oleh enzim sitokrom untuk mempertahankan konsentrasi sirkulasi obat utama yang lebih tinggi.[24] Pada bulan November tahun itu, Pfizer mengumumkan hasil fase 2/3 yang positif, termasuk pengurangan rawat inap sebesar 89% ketika diberikan dalam waktu tiga hari setelah timbulnya gejala.[25][26]
Kegunaan dalam medis
[sunting | sunting sumber]HIV
[sunting | sunting sumber]Ritonavir diindikasikan dalam kombinasi dengan agen antiretroviral lain untuk pengobatan pasien yang terinfeksi HIV-1.[3][4][5] Meskipun awalnya dikembangkan sebagai pengobatan antivirus independen, obat ini paling umum digunakan sebagai penambah farmakokinetika, untuk meningkatkan konsentrasi plasma antiretroviral lain.[27][28] Ritonavir efektif dalam mencegah replikasi HIV-1. Penghambat protease termasuk ritonavir secara efektif memblokir HIV-1 protease, enzim penting dalam siklus reproduksi HIV-1.[29]
COVID-19
[sunting | sunting sumber]Dua penghambat SARS-CoV-2 3CLpro dikemas dengan ritonavir untuk meningkatkan konsentrasi darahnya.[30]
Pada bulan Desember 2021, kombinasi nirmatrelvir dan ritonavir diberikan otorisasi penggunaan darurat oleh Badan Pengawas Obat dan Makanan Amerika Serikat (FDA) untuk pengobatan penyakit virus corona COVID-19.[31][32][33] Obat-obatan yang dikemas bersama tersebut dijual dengan merek dagang Paxlovid.[32][33][34] Paxlovid tidak diizinkan untuk pencegahan prapajanan atau pascapajanan COVID-19 atau untuk memulai pengobatan bagi mereka yang memerlukan rawat inap karena COVID-19 yang parah atau kritis.[32] Pada tanggal 31 Desember 2021, Badan Pengatur Obat-obatan dan Produk Kesehatan Britania Raya (MHRA) menyetujui kombinasi yang sama "untuk orang dengan COVID-19 ringan hingga sedang yang berisiko tinggi mengalami COVID-19 yang parah".[35][36]
Pada bulan Januari 2023, simnotrelvir/ritonavir disetujui secara bersyarat oleh Badan Pengawas Produk Medis Nasional Cina (NMPA) untuk COVID-19.[30]
Kegunaan lain
[sunting | sunting sumber]Penggunaan ritonavir sebagai penghambat CYP3A juga terlihat dalam obat Hepatitis C ombitasvir/paritaprevir/ritonavir.[6]
Efek samping
[sunting | sunting sumber]Bila diberikan pada dosis awal yang lebih tinggi yang efektif untuk terapi anti-HIV, efek samping ritonavir adalah seperti yang ditunjukkan di bawah ini.[3]
- Astenia, malaise
- Diare
- Mual dan muntah
- Nyeri perut
- Pusing
- Insomnia
- Gagal ginjal
- Berkeringat
- Kelainan pengecapan
- Efek metabolik, termasuk
- Hiperkolesterolemia
- Hipertrigliseridemia
- Peningkatan transaminase
- Peningkatan kreatin kinase
Reaksi obat yang merugikan
[sunting | sunting sumber]Ritonavir menunjukkan aktivitas hati.[37] Obat ini menginduksi CYP1A2 serta menghambat CYP3A4 dan CYP2D6. Terapi ritonavir bersamaan dengan berbagai obat dapat mengakibatkan interaksi obat yang serius dan terkadang fatal.[38]
Karena menjadi penghambat kuat (yang menyebabkan setidaknya peningkatan lima kali lipat dalam nilai AUC plasma, atau lebih dari 80% penurunan pembersihan) dari kedua enzim sitokrom P450 CYP2D6 dan CYP3A4, ritonavir dapat secara signifikan memperkuat dan memperpanjang waktu paruh dan/atau meningkatkan konsentrasi darah fenobarbital, primidon, karbamazepin, fenitoin, penghambat PDE5 seperti sildenafil, opioid seperti hidrokodon, oksikodon, petidin dan fentanil, agen antiaritmia seperti amiodaron, propafenon dan disopiramid, imunosupresan seperti takrolimus, voklosporin dan sirolimus, neuroleptik seperti klozapin, lurasidon dan pimozid, serta beberapa agen kemoterapi, benzodiazepin dan beberapa turunan ergot.[39][40] FDA telah mengeluarkan peringatan dalam bentuk kotak untuk jenis interaksi obat ini.[6]
Induktor CYP3A4 dapat melawan efek penghambatan ritonavir dan menyebabkan penurunan drastis kadar obat "yang ditingkatkan", sehingga meningkatkan risiko timbulnya resistensi obat. Penghambat CYP3A4 lainnya mungkin memiliki efek aditif dengan ritonavir, yang menyebabkan peningkatan kadar obat.[6]
Farmakologi
[sunting | sunting sumber]
Farmakodinamik
[sunting | sunting sumber]Ritonavir awalnya dikembangkan sebagai penghambat HIV-1 protease,[41] salah satu dari keluarga penghambat molekul kecil simetris pseudo-C2.[42]
Ritonavir jarang digunakan untuk aktivitas antivirusnya sendiri tetapi tetap banyak digunakan sebagai penguat penghambat protease lainnya. Lebih khusus lagi, ritonavir digunakan untuk menghambat enzim tertentu, di usus, hati, dan di tempat lain, yang biasanya memetabolisme penghambat protease, sitokrom P450-3A4 (CYP3A4). Obat ini mengikat dan menghambat CYP3A4, sehingga dosis rendah dapat digunakan untuk meningkatkan penghambat protease lainnya. Penemuan ini secara drastis mengurangi efek samping dan meningkatkan kemanjuran penghambat protease dan HAART.[43][44] Akan tetapi, karena peran umum CYP3A4 dalam metabolisme ksenobiotik, pemberian dosis dengan ritonavir juga memengaruhi kemanjuran banyak obat lain, yang menambah tantangan dalam meresepkan obat secara bersamaan.[6][45]
Farmakokinetik
[sunting | sunting sumber]Ritonavir pada dosis 200 mg mencapai konsentrasi plasma maksimum dalam waktu sekitar 3 jam dan memiliki waktu paruh 3-4 jam.[2] Yang penting, farmakokinetika Ritonavir tidak linier -- waktu paruh meningkat pada dosis yang lebih tinggi atau di bawah dosis berulang. Misalnya, waktu paruh tablet 500 mg adalah 4-6 jam, bukan 3-4 jam untuk tablet 200 mg. Obat ini memiliki bioavailabilitas yang tinggi tetapi sekitar 20% hilang karena metabolisme lintas pertama.[1] Kapsul Rivonavir tidak diserap secepat tablet Ritonavir dan mungkin menunjukkan bioavailabilitas yang berbeda.[5]
Ritonavir terbukti memiliki potensi in vitro sebesar EC50=0,02 μM pada protease HIV-1 dan konsentrasi yang sangat berkelanjutan dalam plasma setelah pemberian oral pada beberapa spesies tikus.[46]
Kimia
[sunting | sunting sumber]Ritonavir awalnya berasal dari molekul kecil yang cukup kuat dan dapat diserap secara oral, yakni A-80987. Kelompok heterosiklik P3 dan P2′ dari A-80987 didesain ulang untuk membuat analog, yang sekarang dikenal sebagai ritonavir, dengan sifat farmakokinetik yang lebih baik dari aslinya.[46]
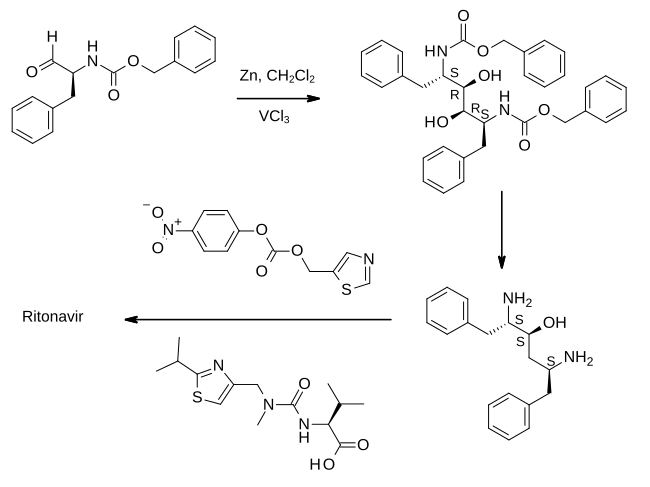
Rincian lengkap sintesis ritonavir pertama kali dipublikasikan oleh para ilmuwan dari Abbott Laboratories.
Pada langkah pertama yang ditunjukkan, aldehida yang berasal dari fenilalanina diolah dengan debu seng dengan adanya vanadium(III) klorida. Hal ini menghasilkan reaksi penggandengan pinakol yang mendimerisasi bahan tersebut untuk menghasilkan zat antara yang diubah menjadi epoksidanya dan kemudian direduksi menjadi (2S,3S,5S)-2,5-diamino-1,6-difenilheksan-3-ol. Yang penting, hal ini mempertahankan stereokimia absolut dari prekursor asam amino. Diamina kemudian diperlakukan secara berurutan dengan dua turunan tiazol, masing-masing dihubungkan oleh ikatan amida, untuk menghasilkan ritonavir.[41][47]
Polimorfisme dan penarikan pasar sementara
[sunting | sunting sumber]Ritonavir awalnya tersedia dalam bentuk kapsul yang tidak memerlukan pendinginan. Kapsul ini berisi bentuk kristal ritonavir yang sekarang disebut bentuk I.[48] Namun, seperti banyak obat lainnya, ritonavir kristal dapat menunjukkan polimorfisme, yaitu molekul yang sama dapat mengkristal menjadi lebih dari satu jenis kristal, atau polimorf, yang masing-masing mengandung molekul berulang yang sama tetapi dalam kemasan/susunan kristal yang berbeda. Kelarutan dan bioavailabilitas dapat bervariasi dalam susunan yang berbeda, dan ini diamati untuk bentuk I dan II ritonavir.[49]
Selama pengembangan, ritonavir diperkenalkan pada tahun 1996, hanya bentuk kristal yang sekarang disebut bentuk I yang ditemukan. Namun, pada tahun 1998, polimorf yang lebih stabil (bentuk II) ditemukan dengan energi bebas Gibbs yang lebih rendah[50]. Bentuk kristal yang lebih stabil ini kurang larut, yang mengakibatkan bioavailabilitas yang jauh lebih rendah. Bioavailabilitas oral obat yang terganggu menyebabkan penarikan sementara formulasi kapsul oral dari pasaran.[49] Sebagai konsekuensi dari fakta bahwa bahkan sejumlah kecil bentuk II dapat mengakibatkan konversi bentuk I yang lebih bioavailabilitasnya menjadi bentuk II, keberadaan bentuk II mengancam kehancuran persediaan formulasi kapsul oral ritonavir yang ada; dan memang, bentuk II ditemukan di jalur produksi, yang secara efektif menghentikan produksi ritonavir.[48] Abbott (sekarang AbbVie) menarik kapsul dari pasaran, dan dokter yang meresepkan didorong untuk beralih ke suspensi Norvir.[butuh rujukan] Diperkirakan bahwa Abbott kehilangan lebih dari US$250 juta sebagai akibatnya, dan insiden tersebut sering disebut sebagai contoh besar dari hilangnya polimorf.[51]
Pada tahun 2000, Abbott (sekarang AbbVie) menerima persetujuan FDA untuk formulasi tablet lopinavir/ritonavir yang mengandung preparat ritonavir yang tidak memerlukan pendinginan.[52] Tablet ritonavir yang diproduksi dalam dispersi padat dengan ekstrusi leleh ditemukan tetap dalam bentuk I, dan diperkenalkan kembali secara komersial pada tahun 2010.[53]
Dalam budaya masyarakat
[sunting | sunting sumber]Ekonomi
[sunting | sunting sumber]Pada tahun 2003, Abbott (AbbVie, Inc.) menaikkan harga Norvir dari US$1,71 per hari menjadi US$8,57 per hari, yang menyebabkan klaim adanya penipuan harga oleh kelompok pasien dan beberapa anggota Kongres. Kelompok konsumen Essential Inventions mengajukan petisi kepada NIH untuk membatalkan paten Norvir, tetapi NIH mengumumkan pada tanggal 4 Agustus 2004 bahwa mereka tidak memiliki hak hukum untuk mengizinkan produksi Norvir secara generik.[54]
Referensi
[sunting | sunting sumber]- ^ a b Hsu A, Granneman GR, Witt G, Locke C, Denissen J, Molla A, et al. (May 1997). "Multiple-dose pharmacokinetics of ritonavir in human immunodeficiency virus-infected subjects". Antimicrobial Agents and Chemotherapy. 41 (5): 898–905. doi:10.1128/aac.41.5.898. PMC 163822
 . PMID 9145841.
. PMID 9145841.
- ^ a b Danner SA, Carr A, Leonard JM, Lehman LM, Gudiol F, Gonzales J, Raventos A, Rubio R, Bouza E, Pintado V, Aguado AG, Garcia de Lomas J, Delgado R, Borleffs JC, Hsu A, Valdes JM, Boucher CA, Cooper DA (December 1995). "A short-term study of the safety, pharmacokinetics, and efficacy of ritonavir, an inhibitor of HIV-1 protease. European-Australian Collaborative Ritonavir Study Group". The New England Journal of Medicine. 333 (23): 1528–1533. doi:10.1056/NEJM199512073332303. hdl:2445/121979
 . PMID 7477167.
. PMID 7477167.
- ^ a b c d "Norvir- ritonavir tablet, film coated Norvir- ritonavir solution Norvir- ritonavir powder". DailyMed. Diarsipkan dari versi asli tanggal November 18, 2021. Diakses tanggal November 17, 2021.
- ^ a b c "Norvir EPAR". European Medicines Agency (EMA). September 17, 2018. Diarsipkan dari versi asli tanggal October 2, 2018. Diakses tanggal August 20, 2020. Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ a b c d e f g h "Ritonavir". The American Society of Health-System Pharmacists. Diarsipkan dari versi asli tanggal October 17, 2015. Diakses tanggal October 23, 2015.
- ^ a b c d e Talha B, Dhamoon AS (8 August 2023). "Ritonavir". StatPearls. StatPearls Publishing. PMID 31335032. Diakses tanggal 6 January 2024.
- ^ a b "FDA approves Viekira Pak to treat hepatitis C" (Siaran pers). U.S. Food and Drug Administration (FDA). December 19, 2014. Diarsipkan dari versi asli tanggal October 31, 2015.
- ^ Akinosoglou K, Schinas G, Gogos C (November 2022). "Oral Antiviral Treatment for COVID-19: A Comprehensive Review on Nirmatrelvir/Ritonavir". Viruses. 14 (11): 2540. doi:10.3390/v14112540
 . PMC 9696049
. PMC 9696049  Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 36423149 Periksa nilai|pmid=(bantuan). - ^ "Ritonavir Pregnancy and Breastfeeding Warnings". drugs.com. Diarsipkan dari versi asli tanggal September 7, 2015. Diakses tanggal October 23, 2015.
- ^ British National Formulary 69 (edisi ke-69). Pharmaceutical Pr. March 31, 2015. hlm. 426. ISBN 9780857111562.
- ^ Hacker M (2009). Pharmacology principles and practice. Amsterdam: Academic Press/Elsevier. hlm. 550. ISBN 9780080919225. Diarsipkan dari versi asli tanggal June 17, 2020. Diakses tanggal September 10, 2017.
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. hlm. 509. ISBN 9783527607495. Diarsipkan dari versi asli tanggal June 20, 2021. Diakses tanggal August 27, 2020.
- ^ World Health Organization (2019). World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ World Health Organization (2021). World Health Organization model list of essential medicines: 22nd list (2021). Geneva: World Health Organization. hdl:10665/345533
 . WHO/MHP/HPS/EML/2021.02.
. WHO/MHP/HPS/EML/2021.02.
- ^ a b c Centers for Disease Control Prevention (CDC) (June 2011). "HIV surveillance--United States, 1981-2008" (PDF). MMWR. Morbidity and Mortality Weekly Report. 60 (21): 689–93. PMID 21637182. Diarsipkan dari versi asli (PDF) tanggal September 24, 2015.
- ^ "Ritonavir FDA approval package" (PDF). March 1, 1996. Diarsipkan dari versi asli (PDF) tanggal March 1, 2021. Diakses tanggal August 20, 2020.
- ^ "FDA Approval of HIV Medicines". HIVINFO. Diakses tanggal September 29, 2022.
- ^ Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. (May 2020). "A Trial of Lopinavir-Ritonavir in Adults Hospitalized with Severe Covid-19". The New England Journal of Medicine. 382 (19): 1787–1799. doi:10.1056/NEJMoa2001282
 . PMC 7121492
. PMC 7121492  . PMID 32187464 //www.ncbi.nlm.nih.gov/pmc/articles/PMC7121492
. PMID 32187464 //www.ncbi.nlm.nih.gov/pmc/articles/PMC7121492 |PMC=tidak memiliki judul (bantuan). - ^ Bagheri M, Niavarani A (October 2020). "Molecular dynamics analysis predicts ritonavir and naloxegol strongly block the SARS-CoV-2 spike protein-hACE2 binding". Journal of Biomolecular Structure & Dynamics. 40 (4): 1597–1606. doi:10.1080/07391102.2020.1830854. PMID 33030105 Periksa nilai
|pmid=(bantuan). - ^ Vandyck K, Deval J (August 2021). "Considerations for the discovery and development of 3-chymotrypsin-like cysteine protease inhibitors targeting SARS-CoV-2 infection". Current Opinion in Virology. 49: 36–40. doi:10.1016/j.coviro.2021.04.006. PMC 8075814
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 34029993 Periksa nilai|pmid=(bantuan). - ^ Schooley RT, Carlin AF, Beadle JR, Valiaeva N, Zhang XQ, Clark AE, et al. (September 2021). "Rethinking Remdesivir: Synthesis, Antiviral Activity, and Pharmacokinetics of Oral Lipid Prodrugs". Antimicrobial Agents and Chemotherapy. 65 (10): e0115521. doi:10.1128/AAC.01155-21
 . ISSN 0066-4804. PMC 8448143
. ISSN 0066-4804. PMC 8448143  Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 34310217 Periksa nilai|pmid=(bantuan) //www.ncbi.nlm.nih.gov/pmc/articles/PMC8448143|PMC=tidak memiliki judul (bantuan). - ^ Ahmad B, Batool M, Ain QU, Kim MS, Choi S (August 2021). "Exploring the Binding Mechanism of PF-07321332 SARS-CoV-2 Protease Inhibitor through Molecular Dynamics and Binding Free Energy Simulations". International Journal of Molecular Sciences. 22 (17): 9124. doi:10.3390/ijms22179124
 . PMC 8430524
. PMC 8430524  Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 34502033 Periksa nilai|pmid=(bantuan) //www.ncbi.nlm.nih.gov/pmc/articles/PMC8430524|PMC=tidak memiliki judul (bantuan). - ^ "Pfizer begins dosing in Phase II/III trial of antiviral drug for Covid-19". Clinical Trials Arena. September 2, 2021. Diarsipkan dari versi asli tanggal November 5, 2021. Diakses tanggal November 5, 2021.
- ^ Woodley M (October 19, 2021). "What is Australia's potential new COVID treatment?". Newsgp. Diarsipkan dari versi asli tanggal November 5, 2021. Diakses tanggal November 6, 2021.
- ^ "Pfizer's Novel COVID-19 Oral Antiviral Treatment Candidate Reduced Risk Of Hospitalization Or Death By 89% In Interim Analysis Of Phase 2/3 EPIC-HR Study". November 5, 2021. Diarsipkan dari versi asli tanggal November 16, 2021. Diakses tanggal November 17, 2021.
- ^ Weintraub K (November 5, 2021). "Pfizer antiviral drug could nearly end deaths from COVID-19, company study suggests". USA Today. Diarsipkan dari versi asli tanggal November 5, 2021. Diakses tanggal November 5, 2021.
- ^ "Ritonavir - Patient". clinicalinfo.hiv.gov. Diakses tanggal January 11, 2023.
- ^ "Ritonavir". go.drugbank.com. Diakses tanggal January 11, 2023.
- ^ "Protease". clinicalinfo.hiv.gov. Diakses tanggal January 11, 2023.
- ^ a b Zhu KW (September 2023). "Deuremidevir and Simnotrelvir-Ritonavir for the Treatment of COVID-19". ACS Pharmacology & Translational Science. 6 (9): 1306–1309. doi:10.1021/acsptsci.3c00134. PMC 10496140
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 37705591 Periksa nilai|pmid=(bantuan). - ^ "Paxlovid- nirmatrelvir and ritonavir kit". DailyMed. Diarsipkan dari versi asli tanggal December 31, 2021. Diakses tanggal December 30, 2021.
- ^ a b c "FDA Authorizes First Oral Antiviral for Treatment of COVID-19". U.S. Food and Drug Administration (FDA) (Siaran pers). December 22, 2021. Diarsipkan dari versi asli tanggal December 27, 2021. Diakses tanggal December 22, 2021.
- ^ a b "Pfizer Receives U.S. FDA Emergency Use Authorization for Novel COVID-19 Oral Antiviral Treatment" (Siaran pers). Pfizer. December 22, 2021. Diarsipkan dari versi asli tanggal December 22, 2021. Diakses tanggal December 22, 2021 – via Business Wire.
- ^ "Frequently Asked Questions on the Emergency Use Authorization for Paxlovid for Treatment of COVID-19". U.S. Food and Drug Administration (FDA). December 22, 2021. Diarsipkan dari versi asli (PDF) tanggal January 5, 2022. Diakses tanggal January 3, 2022.
- ^ "Oral COVID-19 antiviral, Paxlovid, approved by UK regulator" (Siaran pers). Medicines and Healthcare products Regulatory Agency. December 31, 2021. Diarsipkan dari versi asli tanggal January 11, 2022. Diakses tanggal January 3, 2022.
- ^ Reed J (December 31, 2021). "Paxlovid: UK medicines regulator approves second Covid antiviral pill". BBC News Online. Diarsipkan dari versi asli tanggal January 1, 2022. Diakses tanggal January 3, 2022.
- ^ Yeh RF, Gaver VE, Patterson KB, Rezk NL, Baxter-Meheux F, Blake MJ, et al. (May 2006). "Lopinavir/ritonavir induces the hepatic activity of cytochrome P450 enzymes CYP2C9, CYP2C19, and CYP1A2 but inhibits the hepatic and intestinal activity of CYP3A as measured by a phenotyping drug cocktail in healthy volunteers". Journal of Acquired Immune Deficiency Syndromes. 42 (1): 52–60. doi:10.1097/01.qai.0000219774.20174.64
 . PMID 16639344.
. PMID 16639344.
- ^ "Ritonavir: Drug Information Provided by Lexi-Comp: Merck Manual Professional". Merck Manuals Professional Edition. April 30, 2008. Diarsipkan dari versi asli tanggal April 30, 2008.
- ^ Stader F, Khoo S, Stoeckle M, Back D, Hirsch HH, Battegay M, Marzolini C (October 2020). "Stopping lopinavir/ritonavir in COVID-19 patients: duration of the drug interacting effect". The Journal of Antimicrobial Chemotherapy. 75 (10): 3084–3086. doi:10.1093/jac/dkaa253. PMC 7337877
 . PMID 32556272.
. PMID 32556272.
- ^ Carpenter M, Berry H, Pelletier AL (May 2019). "Clinically Relevant Drug-Drug Interactions in Primary Care". American Family Physician. 99 (9): 558–564. PMID 31038898.
- ^ a b WO 1994014436, Kempf DJ, Norbeck DW, Sham HL, Zhao C, Sowin TJ, Reno DS, Haight AR, Cooper AJ, "Retroviral protease inhibiting compounds", diterbitkan tanggal July 7, 1994, diberikan kepada Abbott Laboratories.
- ^ Kempf DJ, Norbeck DW, Codacovi L, Wang XC, Kohlbrenner WE, Wideburg NE, et al. (October 1990). "Structure-based, C2 symmetric inhibitors of HIV protease". Journal of Medicinal Chemistry. 33 (10): 2687–2689. doi:10.1021/jm00172a002. PMID 2213822.
- ^ Zeldin RK, Petruschke RA (January 2004). "Pharmacological and therapeutic properties of ritonavir-boosted protease inhibitor therapy in HIV-infected patients". The Journal of Antimicrobial Chemotherapy. 53 (1): 4–9. doi:10.1093/jac/dkh029
 . PMID 14657084.
. PMID 14657084.
- ^ Merry C, Barry MG, Mulcahy F, Ryan M, Heavey J, Tjia JF, et al. (March 1997). "Saquinavir pharmacokinetics alone and in combination with ritonavir in HIV-infected patients". AIDS. 11 (4): F29–F33. doi:10.1097/00002030-199704000-00001. PMID 9084785.
- ^ "Drug Development and Drug Interactions: Table of Substrates, Inhibitors and Inducers". U.S. Food and Drug Administration (FDA). December 3, 2019. Diarsipkan dari versi asli tanggal March 12, 2020. Diakses tanggal February 17, 2020.
- ^ a b Kempf DJ, Sham HL, Marsh KC, Flentge CA, Betebenner D, Green BE, et al. (February 1998). "Discovery of ritonavir, a potent inhibitor of HIV protease with high oral bioavailability and clinical efficacy". Journal of Medicinal Chemistry. 41 (4): 602–617. doi:10.1021/jm970636+. PMID 9484509.
- ^ Vardanyan R, Hruby V (2016). "34: Antiviral Drugs". Synthesis of Best-Seller Drugs. hlm. 698–701. doi:10.1016/B978-0-12-411492-0.00034-1
 . ISBN 9780124114920.
. ISBN 9780124114920.
- ^ a b Bauer J, Spanton S, Henry R, Quick J, Dziki W, Porter W, Morris J (June 2001). "Ritonavir: an extraordinary example of conformational polymorphism". Pharmaceutical Research. 18 (6): 859–866. doi:10.1023/A:1011052932607. PMID 11474792.
- ^ a b Morissette SL, Soukasene S, Levinson D, Cima MJ, Almarsson O (March 2003). "Elucidation of crystal form diversity of the HIV protease inhibitor ritonavir by high-throughput crystallization". Proceedings of the National Academy of Sciences of the United States of America. 100 (5): 2180–2184. doi:10.1073/pnas.0437744100
 . PMC 151315
. PMC 151315  . PMID 12604798 //www.ncbi.nlm.nih.gov/pmc/articles/PMC151315
. PMID 12604798 //www.ncbi.nlm.nih.gov/pmc/articles/PMC151315 |PMC=tidak memiliki judul (bantuan). - ^ Lüttge A (February 1, 2006). "Crystal dissolution kinetics and Gibbs free energy". Journal of Electron Spectroscopy and Related Phenomena. 150 (2): 248–259. Bibcode:2006JESRP.150..248L. doi:10.1016/j.elspec.2005.06.007.
- ^ Bučar DK, Lancaster RW, Bernstein J (June 2015). "Disappearing polymorphs revisited". Angewandte Chemie. 54 (24): 6972–6993. doi:10.1002/anie.201410356. PMC 4479028
 . PMID 26031248.
. PMID 26031248.
- ^ "Kaletra FAQ". AbbVie's Kaletra product information. AbbVie. 2011. Diarsipkan dari versi asli tanggal July 7, 2014. Diakses tanggal July 5, 2014.
- ^ Zhang C, Matzger AJ (February 2017). "A Newly Discovered Racemic Compound of Pioglitazone Hydrochloride Is More Stable than the Commercial Conglomerate". Crystal Growth & Design. 17 (2): 414–417. doi:10.1021/acs.cgd.6b01638. PMC 6752731
 . PMID 31537981.
. PMID 31537981.
- ^ Connolly C (August 5, 2004). "NIH Declines to Enter AIDS Drug Price Battle". The Washington Post. Diarsipkan dari versi asli tanggal August 20, 2008. Diakses tanggal January 16, 2006.
Bacaan lebih lanjut
[sunting | sunting sumber]- Chemburkar SR, Bauer J, Deming K, Spiwek H, Patel K, Morris J, et al. (2000). "Dealing with the Impact of Ritonavir Polymorphs on the Late Stages of Bulk Drug Process Development". Organic Process Research & Development. 4 (5): 413–417. doi:10.1021/op000023y.