Belerang
16S Belerang | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Sampel belerang elemental | |||||||||||||||||||||||||||||||
Garis spektrum belerang | |||||||||||||||||||||||||||||||
| Sifat umum | |||||||||||||||||||||||||||||||
| Pengucapan | /bêlèrang/[1] | ||||||||||||||||||||||||||||||
| Alotrop | lihat alotrop belerang | ||||||||||||||||||||||||||||||
| Penampilan | mikrokristal tersinter berwarna kuning lemon | ||||||||||||||||||||||||||||||
| Belerang dalam tabel periodik | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Nomor atom (Z) | 16 | ||||||||||||||||||||||||||||||
| Golongan | golongan 16 (kalkogen) | ||||||||||||||||||||||||||||||
| Periode | periode 3 | ||||||||||||||||||||||||||||||
| Blok | blok-p | ||||||||||||||||||||||||||||||
| Kategori unsur | nonlogam poliatomik | ||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| ||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Ne] 3s2 3p4 | ||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 6 | ||||||||||||||||||||||||||||||
| Sifat fisik | |||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | ||||||||||||||||||||||||||||||
| Titik lebur | 388,36 K (115,21 °C, 239,38 °F) | ||||||||||||||||||||||||||||||
| Titik didih | 717,8 K (444,6 °C, 832,3 °F) | ||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | alfa: 2.07 g/cm3 beta: 1.96 g/cm3 gama: 1.92 g/cm3 | ||||||||||||||||||||||||||||||
| saat cair, pada t.l. | 1,819 g/cm3 | ||||||||||||||||||||||||||||||
| Titik kritis | 1314 K, 20,7 MPa | ||||||||||||||||||||||||||||||
| Kalor peleburan | mono: 1,727 kJ/mol | ||||||||||||||||||||||||||||||
| Kalor penguapan | mono: 45 kJ/mol | ||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 22,75 J/(mol·K) | ||||||||||||||||||||||||||||||
Tekanan uap
| |||||||||||||||||||||||||||||||
| Sifat atom | |||||||||||||||||||||||||||||||
| Bilangan oksidasi | −2, −1, 0, +1, +2, +3, +4, +5, +6 (oksida asam kuat) | ||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 2,58 | ||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 999,6 kJ/mol ke-2: 2252 kJ/mol ke-3: 3357 kJ/mol (artikel) | ||||||||||||||||||||||||||||||
| Jari-jari kovalen | 105±3 pm | ||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 180 pm | ||||||||||||||||||||||||||||||
| Lain-lain | |||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | ||||||||||||||||||||||||||||||
| Struktur kristal | ortorombus | ||||||||||||||||||||||||||||||
| Konduktivitas termal | 0,205 W/(m·K) (amorf) | ||||||||||||||||||||||||||||||
| Resistivitas listrik | 2×1015 Ω·m (suhu 20 °C) (amorf) | ||||||||||||||||||||||||||||||
| Arah magnet | diamagnetik[2] | ||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | (α) −15,5×10−6 cm3/mol (298 K)[3] | ||||||||||||||||||||||||||||||
| Modulus curah | 7,7 GPa | ||||||||||||||||||||||||||||||
| Skala Mohs | 2,0 | ||||||||||||||||||||||||||||||
| Nomor CAS | 7704-34-9 | ||||||||||||||||||||||||||||||
| Sejarah | |||||||||||||||||||||||||||||||
| Penemuan | orang Tionghoa[4] (sebelum 2000 SM) | ||||||||||||||||||||||||||||||
| Diketahui sebagai unsur kimia oleh | A. Lavoisier (1777) | ||||||||||||||||||||||||||||||
| Isotop belerang yang utama | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Belerang (bahasa Latin: sulphur; bahasa Inggris: sulfur atau sulphur), yang juga disebut sulfur, adalah unsur kimia dengan lambang S dan nomor atom 16. Belerang merupakan unsur nonlogam yang melimpah dan multivalen. Dalam kondisi normal, atom belerang membentuk molekul oktatomik siklik dengan rumus kimia S8. Belerang elemental adalah padatan kristal kuning cerah pada suhu kamar.
Belerang adalah unsur paling melimpah kesepuluh berdasarkan massa di alam semesta dan paling banyak kelima di Bumi. Meskipun terkadang ditemukan dalam bentuk asli yang murni, belerang di Bumi biasanya terdapat sebagai mineral sulfida dan sulfat. Karena berlimpah dalam bentuk aslinya, belerang telah dikenal sejak zaman kuno, dan kegunaannya telah disebutkan di zaman India Kuno, Yunani Kuno, Tiongkok Kuno, dan Mesir Kuno. Secara historis dan dalam literatur, belerang juga disebut sebagai brimstone,[5] yang berarti "batu yang terbakar".[6] Saat ini, hampir semua belerang elemental diproduksi sebagai produk sampingan dari penghilangan kontaminan yang mengandung belerang dari gas alam dan minyak bumi.[7][8] Penggunaan belerang komersial terbesar adalah produksi asam sulfat untuk pupuk sulfat dan fosfat, dan proses kimia lainnya. Belerang digunakan dalam korek api, insektisida, dan fungisida. Banyak senyawa belerang yang berbau, dan bau gas belerang seperti bau gas alam, aroma sigung, limau gedang, dan bawang putih disebabkan oleh senyawa organobelerang. Hidrogen sulfida memberikan bau khas pada telur busuk dan proses biologis lainnya.
Belerang merupakan unsur penting bagi semua kehidupan, tetapi hampir selalu dalam bentuk senyawa organobelerang atau logam sulfida. Asam amino (dua proteinogenik: sisteina dan metionina, dan banyak nonkode lainnya: sistina, taurina, dll.) serta dua vitamin (biotin dan tiamina) adalah senyawa organobelerang yang sangat penting untuk kehidupan. Banyak kofaktor yang juga mengandung sulfur, termasuk glutationa, dan protein besi–belerang. Disulfida, ikatan S–S, memberikan kekuatan mekanik dan ketidaklarutan (antara lain) protein keratin, yang ditemukan pada kulit luar, rambut, dan bulu. Belerang adalah salah satu unsur kimia inti yang dibutuhkan untuk fungsi biokimia dan merupakan makronutrien elemental unsur untuk semua organisme hidup.
Karakteristik
[sunting | sunting sumber]
Sifat fisik
[sunting | sunting sumber]Belerang membentuk beberapa molekul poliatomik. Alotrop yang paling terkenal adalah oktasulfur, siklo-S8. Grup titik siklo-S8 adalah D4d dan momen dipolnya adalah 0 D.[9] Oktasulfur adalah padatan lembut berwarna kuning cerah yang tak berbau, tetapi sampel tak murni memiliki bau yang mirip dengan korek api.[10] Ia melebur pada 115,21 °C (239,38 °F), mendidih pada 444,6 °C (832,3 °F),[5] dan menyublim kurang lebih antara 20 °C (68 °F) dan 50 °C (122 °F).[11] Pada 95,2 °C (203,4 °F), di bawah suhu leburnya, siklo-oktasulfur berubah dari α-oktasulfur menjadi β-polimorf.[12] Struktur cincin S8 hampir tidak berubah oleh perubahan fasa ini, yang memengaruhi interaksi antarmolekul. Di antara suhu lebur dan didihnya, oktasulfur mengubah alotropnya lagi, berubah dari β-oktasulfur menjadi γ-sulfur, sekali lagi disertai dengan massa jenis yang lebih rendah tetapi kekentalan meningkat karena pembentukan polimer.[12] Pada suhu yang lebih tinggi, kekentalan menurun saat depolimerisasi terjadi. Belerang cair mengasumsikan warna merah tua di atas 200 °C (392 °F). Massa jenis belerang sekitar 2 g/cm3, tergantung pada alotropnya; semua alotrop stabil adalah insulator listrik yang sangat baik.
Belerang tidak larut dalam air tetapi larut dalam karbon disulfida dan, pada tingkat lebih rendah, dalam pelarut organik nonpolar lainnya, seperti benzena dan toluena.
Sifat kimia
[sunting | sunting sumber]Dalam kondisi normal, belerang akan terhidrolisis sangat lambat untuk membentuk terutama hidrogen sulfida dan asam sulfat:
- ½ S8 + 4 H2O → 3 H2S + H2SO4
Reaksi tersebut melibatkan adsorpsi proton ke gugus S8, diikuti dengan disproporsionasi ke dalam produk reaksi.[13]
Energi ionisasi belerang kedua, keempat, dan keenam masing-masing adalah 2252 kJ/mol−1, 4556 kJ/mol−1, dan 8495,8 kJ/mol−1. Komposisi produk reaksi belerang dengan oksidan (dan keadaan oksidasinya) bergantung pada apakah pelepasan energi reaksi mengatasi ambang batas ini. Menerapkan katalis dan/atau suplai energi luar dapat memvariasikan keadaan oksidasi belerang dan komposisi produk reaksi. Walaupun reaksi antara belerang dan oksigen pada kondisi normal menghasilkan belerang dioksida (keadaan oksidasi +4), pembentukan belerang trioksida (keadaan oksidasi +6) membutuhkan suhu 400 – 600 °C dan adanya katalis.
Dalam reaksi dengan unsur-unsur dengan keelektronegatifan yang lebih rendah, ia bereaksi sebagai oksidan dan membentuk sulfida, di mana ia memiliki tingkat oksidasi –2.
Belerang bereaksi dengan hampir semua unsur lain kecuali gas mulia, bahkan dengan logam iridium yang terkenal tak reaktif (menghasilkan iridium disulfida).[14] Beberapa dari reaksi tersebut membutuhkan suhu tinggi.[15]
Alotrop
[sunting | sunting sumber]
Belerang membentuk lebih dari 30 alotrop padat, lebih banyak dari unsur lainnya.[16] Selain S8, beberapa cincin lain telah diketahui.[17] Menghapus satu atom dari mahkota S8 akan memberi S7, yang lebih berwarna kuning tua daripada S8. Analisi HPLC dari "belerang elemental" mengungkapkan campuran kesetimbangan dari terutama S8, tetapi dengan S7 dan sejumlah kecil S6.[18] Cincin yang lebih besar telah dipersiapkan, termasuk S12 dan S18.[19][20]
Belerang amorf atau "plastik" dihasilkan dengan pendinginan cepat dari belerang cair—misalnya, dengan menuangkannya ke dalam air dingin. Studi kristalografi sinar-X menunjukkan bahwa bentuk amorf mungkin memiliki struktur heliks dengan delapan atom per putaran. Molekul polimer melingkar panjang membuat zat kecoklatan menjadi elastis, dan dalam jumlah besar bentuk ini terasa seperti karet mentah. Bentuk ini metastabil pada suhu kamar dan secara bertahap kembali ke alotrop molekul kristal, yang tidak lagi elastis. Proses ini terjadi dalam hitungan jam hingga hari, tetapi dapat dikatalisasi dengan cepat.
Isotop
[sunting | sunting sumber]Bagian ini membutuhkan rujukan tambahan agar kualitasnya dapat dipastikan. |
Belerang memiliki 23 isotop yang diketahui, empat di antaranya stabil: 32S (94,99%±0,26%), 33S (0,75%±0,02%), 34S (4,25%±0,24%), dan 36S (0,01%±0,01%).[21][22] Selain 35S, dengan waktu paruh 87 hari, isotop belerang yang radioaktif memiliki waktu paruh kurang dari 3 jam.
Kelebihan 32S dijelaskan oleh produksinya dalam proses alfa (salah satu kelas utama reaksi fusi nuklir) di dalam bintang yang meledak. Isotop belerang stabil lainnya diproduksi dalam proses bypass yang terkait dengan 34Ar, dan komposisinya bergantung pada jenis ledakan bintang. Misalnya, lebih banyak 33S yang berasal dari nova, daripada dari supernova.[23]
Di planet Bumi, komposisi isotop belerang ditentukan oleh Matahari. Meskipun diasumsikan bahwa distribusi isotop belerang yang berbeda harus kurang lebih sama, telah ditemukan bahwa proporsi dua isotop belerang yang paling melimpah, 32S dan 34S, bervariasi dalam sampel yang berbeda. Pengujian rasio isotop (δ34S) ini dalam sampel memungkinkan untuk membuat perkiraan tentang sejarah kimianya, dan dengan dukungan metode lain, memungkinkan untuk menentukan usia sampel, memperkirakan suhu kesetimbangan antara bijih dan air, menentukan pH dan fugasitas oksigen, mengidentifikasi aktivitas bakteri pereduksi sulfat pada saat pembentukan sampel, atau memperkirakan sumber utama belerang dalam ekosistem.[24] Namun, diskusi tentang apa alasan sebenarnya dari pergeseran δ34S, aktivitas biologis atau perubahan pascadeposital, terus berlanjut.[25]
Misalnya, ketika mineral sulfida diendapkan, kesetimbangan isotop antara padatan dan cairan dapat menyebabkan perbedaan kecil pada nilai δ34S mineral kogenetik. Perbedaan antara mineral dapat digunakan untuk memperkirakan suhu kesetimbangan. δ13C dan δ34S dari mineral karbonat dan sulfida yang hidup berdampingan dapat digunakan untuk menentukan pH dan fugasitas oksigen dari fluida pembawa bijih selama pembentukan bijih.
Di sebagian besar ekosistem hutan, sulfat sebagian besar berasal dari atmosfer; pelapukan mineral bijih dan evaporit menyumbangkan belerang. Belerang dengan komposisi isotop yang khas telah digunakan untuk mengidentifikasi sumber polusi, dan belerang yang diperkaya telah ditambahkan sebagai perunut dalam studi hidrologi. Perbedaan kelimpahan alami dapat digunakan dalam sistem di mana terdapat cukup variasi dalam 34S komponen ekosistem. Danau Pegunungan Rocky diperkirakan didominasi oleh sumber sulfat atmosfer dan telah ditemukan memiliki nilai 34S karakteristik dari danau yang diyakini didominasi oleh sumber DAS sulfat.
35S yang radioaktif terbentuk dalam spalasi sinar kosmik 40Ar atmosfer. Fakta ini dapat digunakan untuk membuktikan adanya sedimen atmosfer baru-baru ini (tidak lebih dari 1 tahun) dalam berbagai hal. Isotop ini dapat diperoleh secara artifisial dengan berbagai cara. Dalam praktiknya, reaksi 35Cl + n → 35S + p, yang berjalan pada iradiasi kalium klorida oleh neutron, digunakan.[26] Isotop 35S digunakan dalam berbagai senyawa yang mengandung belerang sebagai pelacak radioaktif untuk banyak penelitian biologis, misalnya digunakan dalam percobaan Hershey–Chase.
Bekerja dengan senyawa yang mengandung isotop ini relatif aman, asalkan senyawa tersebut tidak jatuh ke dalam organisme pelaku eksperimen.[27]
Keterjadian alami
[sunting | sunting sumber]




32S tercipta di dalam bintang masif, pada kedalaman yang suhunya melebihi 2,5×109 K, melalui fusi satu int silikon ditambah satu inti helium.[28] Karena reaksi nuklir ini merupakan bagian dari proses alfa yang menghasilkan unsur-unsur dalam kelimpahan, belerang adalah unsur paling umum ke-10 di alam semesta.
Belerang, biasanya sebagai sulfida, terdapat dalam banyak jenis meteorit. Kondrit biasa mengandung rata-rata 2,1% belerang, dan kondrit karbon mengandung sebanyak 6,6%. Ia biasanya hadir sebagai troilit (FeS), tetapi terdapat pengecualian, dengan kondrit karbon yang mengandung belerang bebas, sulfat dan senyawa belerang lainnya.[29] Warna khas satelit vulkanis Jupiter Io dikaitkan dengan berbagai bentuk belerang cair, padat, dan gas.[30]
Belerang adalah unsur paling umum kelima berdasarkan massa di Bumi. Belerang elemental dapat ditemukan di dekat mata air panas dan daerah vulkanis di banyak belahan dunia, terutama di sepanjang Cincin Api Pasifik; deposit vulkanis tersebut saat ini ditambang di Indonesia, Chili, dan Jepang. Endapan ini adalah polikristalin, dengan kristal tunggal terbesar yang terdokumentasi berukuran 22×16×11 cm.[31] Secara historis, Sisilia adalah sumber utama belerang pada Revolusi Industri.[32] Danau belerang cair dengan diameter hingga ~200 m telah ditemukan di dasar laut, terkait dengan gunung berapi bawah laut, pada kedalaman di mana titik didih air lebih tinggi daripada titik lebur belerang.[33]
Belerang asli disintesis oleh bakteri anaerob yang bekerja pada mineral sulfat seperti gipsum dalam kubah garam.[34][35] Endapan yang signifikan dalam kubah garam terjadi di sepanjang pantai Teluk Meksiko, dan di evaporit di Eropa Timur dan Asia Barat. Belerang asli dapat diproduksi oleh proses geologi saja. Endapan belerang berbasis fosil dari kubah garam pernah menjadi basis produksi komersial di Amerika Serikat, Rusia, Turkmenistan, dan Ukraina.[36] Saat ini, produksi komersial masih dilakukan di tambang Osiek di Polandia. Sumber-sumber tersebut sekarang memiliki kepentingan komersial sekunder, dan sebagian besar tidak lagi berfungsi.
Senyawa belerang alami yang umum ialah mineral sulfida, seperti pirit (besi sulfida), sinabar (raksa sulfida), galena (timbal sulfida), sfalerit (seng sulfida), dan stibnit (antimon sulfida); dan mineral sulfat, seperti gipsum (kalsium sulfat), alunit (kalium aluminium sulfat), dan barit (barium sulfat). Di Bumi, seperti di satelit Jupiter Io, belerang elemental terjadi secara alami dalam emisi vulkanis, termasuk emisi dari ventilasi hidrotermal.
Sumber belerang industri utama sekarang adalah minyak bumi dan gas alam.[7]
Senyawa
[sunting | sunting sumber]Keadaan oksidasi belerang berkisar dari −2 hingga +6. Belerang membentuk senyawa yang stabil dengan semua unsur kecuali gas mulia.
Reaksi transfer elektron
[sunting | sunting sumber]
Polikation belerang, S82+, S42+, dan S162+ dihasilkan ketika belerang direaksikan dengan zat pengoksidasi dalam larutan asam kuat.[37] Larutan berwarna yang dihasilkan dengan melarutkan belerang dalam oleum pertama kali dilaporkan pada tahun 1804 oleh C.F. Bucholz, tetapi penyebab warna dan struktur polikation yang terlibat baru ditentukan pada akhir 1960-an. S82+ berwarna biru tua, S42+ berwarna kuning, dan S162+ berwarna merah.[12]
Reduksi belerang menghasilkan berbagai polisulfida dengan rumus Sx2-, banyak di antaranya telah diperoleh bentuk kristal. Ilustratif adalah produksi natrium tetrasulfida:
- 4 Na + S
8 → 2 Na
2S
4
Beberapa dianion ini berdisosiasi menjadi anion radikal, seperti S3− yang memberi warna biru pada batu lapis lazuli.

Reaksi ini menyoroti sifat khas belerang: kemampuannya untuk mengatenasi (mengikat dirinya sendiri melalui pembentukan rantai). Protonasi anion polisulfida ini menghasilkan polisulfan, H2Sx dengan x= 2, 3, dan 4.[39] Pada akhirnya, reduksi belerang akan menghasilkan garam sulfida:
- 16 Na + S8 → 8 Na2S
Interkonversi spesies ini dieksploitasi dalam baterai natrium–belerang.
Hidrogenasi
[sunting | sunting sumber]Perlakuan belerang dengan hidrogen menghasilkan hidrogen sulfida. Ketika dilarutkan dalam air, hidrogen sulfida bersifat agak asam:[5]
- H2S
 HS− + H+
HS− + H+
Gas hidrogen sulfida dan anion hidrosulfida sangat beracun bagi mamalia, karena menghambat kapasitas pembawa oksigen dari hemoglobin dan sitokrom tertentu dengan cara yang analog dengan sianida dan azida (lihat di bawah, di bagian pencegahan).
Pembakaran
[sunting | sunting sumber]Dua oksida belerang utama diperoleh dengan membakar belerang:
- S + O2 → SO2 (belerang dioksida)
- 2 SO2 + O2 → 2 SO3 (belerang trioksida)
Banyak oksida belerang lain yang teramati termasuk oksida kaya belerang seperti belerang monoksida, disulfur monoksida, disulfur dioksida, dan oksida yang lebih tinggi yang mengandung gugus perokso.
Halogenasi
[sunting | sunting sumber]Belerang bereaksi dengan fluorin menghasilkan belerang tetrafluorida yang sangat reaktif dan belerang heksafluorida yang sangat lengai.[40] Fluorin menghasilkan senyawa S(IV) dan S(VI), sementara klorin menghasilkan turunan S(II) dan S(I). Jadi, belerang diklorida, disulfur diklorida, dan klorosulfan yang lebih tinggi muncul dari klorinasi belerang. Sulfuril klorida dan asam klorosulfat adalah turunan dari asam sulfat; tionil klorida (SOCl2) adalah reagen umum dalam sintesis organik.[41]
Pseudohalida
[sunting | sunting sumber]Belerang mengoksidasi sianida dan sulfit untuk menghasilkan masing-masing tiosianat dan tiosulfat.
Logam sulfida
[sunting | sunting sumber]Belerang bereaksi dengan banyak logam. Logam elektropositif menghasilkan garam polisulfida. Tembaga, seng, perak akan diserang oleh belerang, lihat menodai. Meskipun banyak logam sulfida yang diketahui, sebagian besar dibuat dengan reaksi suhu tinggi dari unsur-unsur tersebut.[42]
Senyawa organik
[sunting | sunting sumber]- Ilustrasi senyawa organobelerang
-
Alisin, senyawa kimia dalam bawang putih
-
(R)-sisteina, asam amino yang mengandung gugus tiol
-
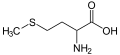
Metionina, asam amino yang mengandung tioeter
-
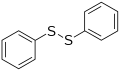
Difenil disulfida, perwakilan disulfida
-
Asam perfluorooktanasulfonat, sebuah surfaktan
-
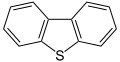
Dibenzotiofena, komponen minyak mentah
-
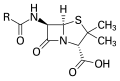
Penisilin, antibiotik di mana "R" adalah gugus variabel
Beberapa kelas utama senyawa organik yang mengandung belerang meliputi:[43]
- Tiol atau merkaptan (disebut demikian karena mereka menangkap raksa sebagai pengelat) adalah analog alkohol dari belerang; perlakuan tiol dengan basa menghasilkan ion tiolat.
- Tioeter adalah analog eter dari belerang.
- Ion sulfonium memiliki tiga kelompok yang melekat pada pusat belerang kationik. Dimetilsulfoniopropionat (DMSP) adalah salah satu senyawa penting dalam siklus belerang organik laut.
- Sulfoksida dan sulfona adalah tioeter dengan satu dan dua atom oksigen yang masing-masing terikat pada atom belerang. Sulfoksida yang paling sederhana, dimetil sulfoksida, adalah pelarut yang umum; sulfona yang umum adalah sulfolana.
- Asam sulfonat digunakan dalam banyak detergen.
Senyawa dengan ikatan rangkap karbon–belerang jarang terjadi, kecuali karbon disulfida, cairan nirwarna yang volatil yang secara struktural mirip dengan karbon dioksida. Ia digunakan sebagai reagen untuk membuat polimer rayon dan banyak senyawa organobelerang. Tidak seperti karbon monoksida, karbon monosulfida hanya stabil sebagai gas yang sangat encer, ditemukan di antara tata surya.[44]
Senyawa organobelerang bertanggung jawab atas beberapa bau tak sedap dari bahan organik yang membusuk. Mereka secara luas dikenal sebagai bau dalam gas alam domestik, bau bawang putih, dan semprotan sigung. Tidak semua senyawa belerang organik berbau tidak sedap pada semua konsentrasi: monoterpenoid (merkaptan limau gedang) yang mengandung belerang dalam konsentrasi kecil adalah aroma khas limau gedang, tetapi memiliki bau tiol generik pada konsentrasi yang lebih besar. Mustard belerang, sebuah vesikan yang kuat, digunakan dalam Perang Dunia I sebagai agen penonaktifan.[45]
Ikatan belerang–belerang adalah komponen struktural yang digunakan untuk mengeraskan karet, mirip dengan jembatan disulfida yang mengeraskan protein (lihat biologi di bawah). Dalam the most common type of industrial "pengawetan" atau pengerasan dan penguatan karet alam, belerang elemental dipanaskan dengan karet ke titik di mana reaksi kimia membentuk jembatan disulfida antara unit isoprena polimer. Proses ini, yang dipatenkan pada tahun 1843, menjadikan karet sebagai produk industri utama, terutama ban mobil. Karena panas dan belerang, proses itu dinamai vulkanisasi, diambil dari nama dewa penempaan dan vulkanisme Romawi.
Sejarah
[sunting | sunting sumber]Zaman kuno
[sunting | sunting sumber]
Karena berlimpah dalam bentuk aslinya, belerang telah dikenal di zaman kuno dan disebut dalam Taurat (Kejadian). Alkitab Kristen Terjemahan bahasa Inggris biasanya menyebut belerang yang terbakar sebagai "batu belerang" (brimstone), sehingga memunculkan istilah khotbah "api-dan-batu belerang", di mana pendengar diingatkan akan nasib kutukan abadi yang menunggu orang yang tak percaya dan tak mau bertobat. Dari bagian Alkitab inilah[46] Neraka disiratkan sebagai "bau belerang" (kemungkinan karena hubungannya dengan aktivitas gunung berapi). Menurut Papirus Ebers, salep belerang digunakan di Mesir kuno untuk mengobati kelopak mata granular. Belerang digunakan untuk fumigasi di Yunani praklasik;[47] hal ini disebutkan dalam Odisseia.[48] Plinius Tua membahas belerang dalam buku 35 dari Naturalis Historia-nya, mengatakan bahwa sumbernya yang paling terkenal adalah pulau Melos. Dia menyebutkan kegunaannya untuk fumigasi, obat-obatan, dan pemutihan kain.[49]
Suatu bentuk belerang alami yang dikenal sebagai shiliuhuang (石硫黄) dikenal di Tiongkok sejak abad ke-6 SM dan ditemukan di Hanzhong.[50] Pada abad ke-3, orang Tiongkok telah menemukan bahwa belerang dapat diekstraksi dari pirit.[50] Taois Tiongkok tertarik pada sifat belerang yang mudah terbakar dan reaktivitasnya dengan logam tertentu, namun penggunaan praktisnya yang paling awal ditemukan dalam pengobatan tradisional Tionghoa.[50] Sebuah risalah militer Dinasti Song tahun 1044 M menjelaskan berbagai formula bubuk hitam Tiongkok, yang merupakan campuran kalium nitrat (KNO3), arang, dan belerang. Ia tetap menjadi bahan bubuk mesiu hitam.
Ahli alkimia India, praktisi "ilmu kimia" (Sanskerta: रसशास्त्र, translit: rasaśāstra), menulis secara ekstensif tentang penggunaan belerang dalam operasi alkimia dengan raksa, dari abad kedelapan Masehi dan seterusnya.[52] Dalam tradisi rasaśāstra, belerang disebut "yang berbau" (गन्धक, gandhaka).
Ahli alkimia Eropa awal memberi belerang lambang alkimia yang unik, segitiga di atas salib (🜍). (Hal ini terkadang dirancukan dengan lambang tombak silang astronomis ⚴ untuk 2 Pallas.) Variasi yang dikenal sebagai batu belerang memiliki lambang yang menggabungkan salib bergaris dua di atas lambang takhingga (🜏). Dalam perawatan kulit tradisional, belerang elemental digunakan (terutama dalam krim) untuk meringankan kondisi seperti kudis, kurap, psoriasis, dermatitis, dan jerawat. Mekanisme kerjanya tidak diketahui—meskipun belerang elemental tidak teroksidasi perlahan menjadi asam sulfit, yang (melalui aksi sulfit) merupakan agen pereduksi dan antibakteri ringan.[53][54][55]
Zaman modern
[sunting | sunting sumber]Belerang muncul dalam kolom alkali (nonasam) tetap dalam tabel kimia tahun 1718.[57] Antoine Lavoisier menggunakan belerang dalam percobaan pembakaran, menulis beberapa di antaranya pada tahun 1777.[58]
Endapan belerang di Sisilia merupakan sumber dominan selama lebih dari satu abad. Pada akhir abad ke-18, sekitar 2.000 ton belerang per tahun diimpor ke Marseille, Prancis, untuk produksi asam sulfat yang digunakan dalam proses Leblanc. Dalam industrialisasi Inggris, dengan pencabutan bea garam pada tahun 1824, permintaan belerang dari Sisilia melonjak. Meningkatnya kendali dan eksploitasi Inggris atas penambangan, penyulingan, dan pengangkutan belerang, ditambah dengan kegagalan ekspor yang menguntungkan untuk mengubah ekonomi Sisilia yang terbelakang dan miskin, menyebabkan Krisis Belerang tahun 1840, ketika Raja Ferdinand II memonopoli industri belerang ke perusahaan Prancis, melanggar perjanjian perdagangan tahun 1816 sebelumnya dengan Inggris. Solusi damai akhirnya dinegosiasikan oleh Prancis.[59][60]
Pada tahun 1867, belerang elemental ditemukan pada endapan bawah tanah di Louisiana dan Texas. Proses Frasch yang sangat berhasil dikembangkan untuk mengekstrak sumber daya ini.[61]
Pada akhir abad ke-18, pembuat furnitur menggunakan belerang cair untuk menghasilkan inlay dekoratif.[62] Belerang cair terkadang masih digunakan untuk memasang baut baja ke dalam lubang beton yang dibor di mana diperlukan ketahanan kejut yang tinggi untuk titik pemasangan peralatan yang dipasang di lantai. Bubuk belerang murni digunakan sebagai obat tonik dan pencahar.[36]
Dengan munculnya proses kontak, sebagian besar belerang saat ini digunakan untuk membuat asam sulfat untuk berbagai kegunaan, khususnya pupuk.[63]
Belakangan ini, sumber utama belerang telah menjadi minyak bumi dan gas alam. Hal ini disebabkan kebutuhan untuk menghilangkan belerang dari bahan bakar untuk mencegah hujan asam, dan mengakibatkan surplus belerang.[7]
Ejaan dan etimologi
[sunting | sunting sumber]Sulfur berasal dari kata Latin sulpur, yang dihelenisasi menjadi sulphur dalam kepercayaan yang salah bahwa kata Latin itu berasal dari bahasa Yunani. Ejaan ini kemudian ditafsirkan ulang sebagai perwakilan bunyi /f/ dan menghasilkan ejaan sulfur, yang muncul dalam bahasa Latin menjelang akhir periode Klasik. Kata Yunani Kuno yang sebenarnya untuk belerang, θεῖον, theîon (dari sebelumnya θέειον, théeion), adalah sumber dari awalan kimia internasional tio-. Kata Yunani Standar Modern untuk belerang adalah θείο, theío.
Dalam bahasa Anglo-Prancis abad ke-12, belerang disebut sebagai sulfre. Pada abad ke-14, -ph- dari bahasa Latin yang terhelenisasi secara keliru dipulihkan dalam sulphre dari bahasa Inggris Pertengahan. Pada abad ke-15, varian ejaan Latin lengkap sulfur dan sulphur menjadi umum dalam bahasa Inggris. Ejaan f~ph paralel berlanjut di Inggris hingga abad ke-19, ketika kata itu dibakukan sebagai sulphur.[64] Sebaliknya, sulfur adalah bentuk yang dipilih di Amerika Serikat, sedangkan Kanada menggunakan keduanya.
IUPAC mengadopsi ejaan sulfur pada tahun 1990 atau 1971, tergantung pada sumber yang dikutip, tergantung pada sumber yang dikutip,[65] seperti yang dilakukan Nomenclature Committee of the Royal Society of Chemistry pada tahun 1992, mengembalikan ejaan sulfur ke Inggris.[66] Kamus Oxford mencatat bahwa "dalam kimia dan penggunaan teknis lainnya ... ejaan -f- sekarang menjadi bentuk baku untuk belerang dan kata-kata terkait dalam konteks Inggris serta A.S., dan juga semakin banyak digunakan dalam konteks umum."[67]
Produksi
[sunting | sunting sumber]
Belerang dapat ditemukan dengan sendirinya dan secara historis biasanya diperoleh dalam bentuk ini; pirit juga menjadi sumber belerang.[68] Di daerah vulkanik di Sisilia, pada zaman kuno, ia ditemukan di permukaan tanah, dan "proses Sisilia" digunakan: endapan belerang ditumpuk di tempat pembakaran batu bata yang dibangun di lereng bukit yang miring, dengan ruang udara di antaranya. Kemudian, beberapa belerang dihaluskan, disebarkan di atas bijih yang ditumpuk dan dibakar, menyebabkan belerang bebas melebur ke bawah bukit. Akhirnya endapan yang terbawa permukaan dimainkan, dan para penambang menggali deposit yang akhirnya menghiasi lanskap Sisilia dengan tambang labirin. Penambangan tidak mekanis dan padat karya, dengan pemetik membebaskan bijih dari batu, dan anak tambang atau carusi membawa keranjang bijih ke permukaan, seringkali melalui terowongan sepanjang satu mil atau lebih. Setelah bijih berada di permukaan, bijih tersebut direduksi dan diekstraksi dalam oven peleburan. Kondisi di tambang belerang Sisilia sangat mengerikan, mendorong Booker T. Washington untuk menulis "Saya belum siap sekarang untuk mengatakan sejauh mana saya percaya pada neraka fisik di dunia berikutnya, tetapi tambang belerang di Sisilia adalah neraka terdekat yang saya perkirakan untuk dapat dilihat dalam hidup ini."[69]

Belerang elemental diekstraksi dari kubah garam (yang terkadang terjadi dalam bentuk yang hampir murni) hingga akhir abad ke-20. Belerang sekarang diproduksi sebagai produk sampingan dari proses industri lain seperti penyulingan minyak, di mana belerang tidak diinginkan. Sebagai mineral, belerang asli di bawah kubah garam dianggap sebagai sumber daya mineral fosil, yang dihasilkan oleh aksi bakteri anaerob pada endapan sulfat. Ia telah dihapus dari tambang kubah garam terutama oleh proses Frasch.[36] Dalam metode ini, air super panas dipompa ke deposit belerang asli untuk melelehkan belerang, dan kemudian udara terkompresi mengembalikan 99,5% produk cair murni ke permukaan. Sepanjang abad ke-20, prosedur ini menghasilkan belerang elemental yang tidak memerlukan pemurnian lebih lanjut. Karena jumlah deposit belerang yang terbatas dan tingginya biaya pengerjaannya, proses untuk menambang belerang ini belum digunakan secara besar-besaran di mana pun di dunia sejak tahun 2002.[70][71]
Saat ini, belerang diproduksi dari minyak bumi, gas alam, dan sumber daya fosil terkait, yang darinya diperoleh terutama sebagai hidrogen sulfida.[7] Senyawa organobelerang, pengotor yang tidak diinginkan dalam minyak bumi, dapat ditingkatkan dengan melakukan hidrodesulfurisasi, yang memotong ikatan C–S:[70][71]
- R-S-R + 2 H2 → 2 RH + H2S
Hidrogen sulfida yang dihasilkan dari proses ini, dan juga terjadi pada gas alam, diubah menjadi belerang elemental melalui proses Claus. Proses ini memerlukan oksidasi beberapa hidrogen sulfida menjadi sulfur dioksida dan kemudian komproporsionasi keduanya:[70][71]
- 3 O2 + 2 H2S → 2 SO2 + 2 H2O
- SO2 + 2 H2S → 3 S + 2 H2O

Karena kandungan belerang yang tinggi di Pasir Minyak Athabasca, timbunan unsur belerang dari proses ini sekarang ada di seluruh Alberta, Kanada.[72] Cara lain untuk menyimpan belerang adalah sebagai pengikat beton, dan produk yang dihasilkan memiliki banyak sifat yang diinginkan (lihat beton belerang).[73]
Belerang masih ditambang dari endapan permukaan di negara-negara berkembang yang memiliki gunung berapi, seperti Indonesia, dan kondisi para pekerja belum banyak membaik sejak zaman Booker T. Washington.[74]
Produksi belerang dunia pada tahun 2011 mencapai 69 juta ton (Mt), dengan lebih dari 15 negara menyumbang masing-masing lebih dari 1 Mt. Negara-negara penghasil lebih dari 5 Mt adalah Tiongkok (9,6), Amerika Serikat (8,8), Kanada (7,1), dan Rusia (7,1).[75] Produksi belerang perlahan meningkat dari tahun 1900 hingga 2010; harganya tidak stabil pada tahun 1980-an dan sekitar tahun 2010.[76]
Aplikasi
[sunting | sunting sumber]Asam sulfat
[sunting | sunting sumber]Belerang elemental digunakan terutama sebagai prekursor bahan kimia lainnya. Sekitar 85% (1989) diubah menjadi asam sulfat (H2SO4):
- ⅛ S
8 + 3⁄2 O
2 + H
2O → H
2SO
4
Pada tahun 2010, Amerika Serikat memproduksi lebih banyak asam sulfat daripada bahan kimia industri anorganik lainnya.[76] Penggunaan utama asam sulfat adalah ekstraksi bijih fosfat untuk produksi pembuatan pupuk. Aplikasi lain dari asam sulfat ialah penyulingan minyak, pengolahan air limbah, dan ekstraksi mineral.[36]
Kimia belerang penting lainnya
[sunting | sunting sumber]Belerang bereaksi langsung dengan metana dan menghasilkan karbon disulfida, yang digunakan untuk membuat selofan dan rayon.[36] Salah satu kegunaan belerang elemental adalah dalam vulkanisasi karet, di mana rantai polisulfida berikatan silang dengan polimer organik. Sulfit dalam jumlah besar digunakan untuk memutihkan kertas dan mengawetkan buah kering. Banyak dari surfaktan dan detergen (misalnya natrium lauril sulfat) merupakan turunan sulfat. Kalsium sulfat, gipsum, (CaSO4·2H2O) ditambang dalam skala 100 juta ton setiap tahunnya untuk digunakan dalam semen Portland dan pupuk.
Ketika fotografi berbasis perak tersebar luas, natrium dan amonium tiosulfat banyak digunakan sebagai "zat pengikat". Belerang adalah salah satu komponen bubuk mesiu ("bubuk hitam").
Pupuk
[sunting | sunting sumber]Asam amino yang disintesis oleh organisme hidup seperti metionina dan sisteina mengandung gugus organobelerang (masing-masing tioester dan tiol). Antioksidan glutationa yang melindungi banyak organisme hidup terhadap radikal bebas dan stres oksidatif juga mengandung belerang organik. Beberapa tanaman seperti bawang merah dan bawang putih juga menghasilkan senyawa organobelerang yang berbeda seperti sin-propanetial-S-oksida yang menyebabkan iritasi lakrimal (bawang merah), atau dialil disulfida dan alisin (bawang putih). Sulfat, umumnya ditemukan di tanah dan air tanah seringkali merupakan sumber belerang alami yang cukup untuk tanaman dan bakteri. Deposisi atmosfer dari belerang dioksida (SO2) juga merupakan sumber belerang buatan yang umum (pembakaran batu bara) untuk tanah. Dalam keadaan normal, di sebagian besar tanah pertanian, belerang bukanlah nutrisi pembatas bagi tanaman dan mikroorganisme (lihat tong Liebig). Namun, dalam beberapa keadaan, tanah dapat terkuras dalam sulfat, misalnya, jika ini kemudian tercuci oleh air meteorik (hujan) atau jika kebutuhan belerang untuk beberapa jenis tanaman tinggi. Hal ini menjelaskan bahwa belerang semakin dikenal dan digunakan sebagai komponen pupuk. Bentuk belerang yang paling penting untuk pupuk adalah kalsium sulfat, umumnya ditemukan di alam sebagai mineral gipsum (CaSO4·2H2O). Belerang elemental (elemental sulfur, ES) bersifat hidrofobik (tidak larut dalam air) dan tidak dapat digunakan langsung oleh tumbuhan. Belerang elemental kadang-kadang dicampur dengan bentonit untuk memperbaiki tanah yang terkuras untuk tanaman dengan kebutuhan organobelerang yang tinggi. Seiring waktu, proses oksidasi abiotik dengan oksigen atmosfer dan bakteri tanah dapat mengoksidasi dan mengubah belerang elemental menjadi turunan yang larut, yang kemudian dapat digunakan oleh mikroorganisme dan tanaman. Belerang meningkatkan efisiensi nutrisi tanaman penting lainnya, terutama nitrogen dan fosforus.[77] Partikel belerang yang diproduksi secara biologis secara alami bersifat hidrofilik karena lapisan biopolimer dan ia lebih mudah menyebar di atas tanah dalam semprotan bubur yang diencerkan, menghasilkan penyerapan yang lebih cepat oleh tanaman.
Kebutuhan tanaman akan belerang sama atau melebihi kebutuhan fosforus. Ia adalah nutrisi penting untuk pertumbuhan tanaman, pembentukan bintil akar kacang-kacangan, serta sistem kekebalan dan pertahanan. Kekurangan belerang telah meluas di banyak negara di Eropa.[78][79][80] Karena masukan belerang di atmosfer terus menurun, defisit masukan/keluaran belerang cenderung meningkat kecuali jika pupuk belerang digunakan. Masukan atmosfer belerang menurun karena tindakan yang diambil untuk membatasi hujan asam.[77][81]
Fungisida dan pestisida
[sunting | sunting sumber]
Belerang elemental adalah salah satu fungisida dan pestisida tertua. "Belerang pendebu", belerang elemental dalam bentuk bubuk, adalah fungisida umum untuk anggur, stroberi, dan banyak sayuran serta beberapa tanaman lainnya. Ia memiliki khasiat yang baik terhadap berbagai macam penyakit mildu bubuk serta bintik hitam. Dalam produksi organik, belerang adalah fungisida yang paling penting. Ia adalah satu-satunya fungisida yang digunakan dalam produksi apel yang dibudidayakan secara organik untuk melawan penyakit utama keropeng apel dalam kondisi yang lebih dingin. Biosulfur (belerang elemental yang diproduksi secara biologis dengan karakteristik hidrofilik) juga dapat digunakan untuk aplikasi ini.
Belerang pendebu formulasi standar diterapkan pada tanaman dengan pendebu belerang atau dari pesawat penyemprot debu. Belerang yang dapat dibasahi adalah nama komersial untuk belerang pendebu yang diformulasikan dengan bahan tambahan agar dapat tercampur dalam air.[73][82] Ia memiliki aplikasi serupa dan digunakan sebagai fungisida terhadap mildu dan masalah terkait jamur lainnya dengan tanaman dan tanah.
Serbuk belerang elemental digunakan sebagai insektisida "organik" (yaitu, "hijau") (sebenarnya akarisida) terhadap kutu dan tungau. Metode aplikasi yang umum adalah membersihkan pakaian atau anggota badan dengan bubuk belerang.
Larutan belerang kapur yang diencerkan (dibuat dengan menggabungkan kalsium hidroksida dengan belerang elemental dalam air) digunakan pada hewan peliharaan untuk menghancurkan kurap, mange, dan penyakit kulit serta parasit lainnya.
Lilin belerang dari belerang yang hampir murni dibakar untuk memfumigasi struktur dan tong anggur, tetapi sekarang dianggap terlalu beracun untuk tempat tinggal.
Farmasi
[sunting | sunting sumber]Belerang (khususnya oktasulfur, S8) digunakan dalam persiapan kulit farmasi untuk pengobatan jerawat dan kondisi lainnya. Ia bertindak sebagai agen keratolitik dan juga membunuh bakteri, jamur, tungau kudis, dan parasit lainnya.[83] Belerang yang diendapkan dan belerang koloid digunakan, dalam bentuk losion, krim, bedak, sabun, dan aditif mandi, untuk pengobatan jerawat, rosasea, dan dermatitis seboroik.[84]
Banyak obat mengandung belerang.[85] Contoh awalnya adalah sulfonamida antibakteri, yang dikenal sebagai obat sulfa. Contoh yang lebih baru adalah asetilsisteina mukolitik. Belerang adalah bagian dari banyak molekul pertahanan bakteri. Kebanyakan antibiotik β-laktam, termasuk penisilin, sefalosporin, dan monobaktam mengandung belerang.[43]
Baterai
[sunting | sunting sumber]Karena kepadatan energinya yang tinggi dan ketersediaan belerang, ada penelitian berkelanjutan untuk membuat baterai litium-belerang yang dapat diisi ulang. Hingga saat ini, elektrolit karbonat telah menyebabkan kegagalan pada baterai tersebut setelah satu siklus. Pada Februari 2022, para peneliti di Universitas Drexel tidak hanya menciptakan baterai prototipe yang bertahan selama 4000 siklus pengisian ulang, tetapi juga menemukan belerang gamma monoklinik pertama yang tetap stabil di bawah 95 °C.[86]
Peran biologis
[sunting | sunting sumber]Belerang adalah komponen penting dari semua sel hidup. Ia adalah unsur paling melimpah kedelapan dalam tubuh manusia menurut beratnya,[87] kira-kira sama dengan kalium, dan sedikit lebih besar dari natrium dan klorin.[88] Tubuh manusia seberat 70 kg (150 pon) mengandung sekitar 140 gram belerang.[89] Sumber makanan utama belerang bagi manusia adalah asam amino yang mengandung belerang,[90] yang dapat ditemukan dalam protein nabati dan hewani.[91]
Mentransfer belerang antara anorganik dan biomolekul
[sunting | sunting sumber]Pada tahun 1880-an, saat mempelajari Beggiatoa (bakteri yang hidup di lingkungan yang kaya belerang), Sergei Winogradsky menemukan bahwa ia mengoksidasi hidrogen sulfida (H2S) sebagai sumber energi, membentuk tetesan belerang intraseluler. Winogradsky menyebut bentuk metabolisme ini sebagai anorgoksidasi (oksidasi senyawa anorganik).[92] Kontributor lain yang terus mempelajarinya adalah Selman Waksman.[93] Bakteri primitif yang hidup di sekitar ventilasi vulkanik laut dalam mengoksidasi hidrogen sulfida untuk nutrisi mereka, seperti yang ditemukan oleh Robert Ballard.[8]
Pengoksidasi belerang dapat digunakan sebagai sumber energi senyawa belerang tereduksi, termasuk hidrogen sulfida, belerang elemental, sulfit, tiosulfat, dan berbagai politionat (misalnya, tetrationat).[94] Mereka bergantung pada enzim seperti belerang oksigenasa dan sulfit oksidasa untuk mengoksidasi belerang menjadi sulfat. Beberapa litotrof bahkan dapat menggunakan energi yang terkandung dalam senyawa belerang untuk menghasilkan gula, suatu proses yang dikenal sebagai kemosintesis. Beberapa bakteri dan arkea menggunakan hidrogen sulfida sebagai pengganti air sebagai donor elektron dalam kemosintesis, suatu proses yang mirip dengan fotosintesis yang menghasilkan gula dan menggunakan oksigen sebagai akseptor elektron. Kemosintesis berbasis belerang dapat disederhanakan dibandingkan dengan fotosintesis:
- H2S + CO2 → gula + S
- H2O + CO2 → gula + O2
Terdapat bakteri yang menggabungkan dua cara nutrisi ini: bakteri belerang hijau dan bakteri belerang ungu.[95] Juga bakteri pengoksidasi belerang dapat bersimbiosis dengan organisme yang lebih besar, yang memungkinkan untuk menggunakan hidrogen sulfida sebagai makanan untuk dioksidasi. Contoh: cacing tabung raksasa.[96]
Terdapat bakteri pereduksi sulfat, yang, sebaliknya, "menghirup sulfat" alih-alih oksigen. Mereka menggunakan senyawa organik atau molekul hidrogen sebagai sumber energi. Mereka menggunakan belerang sebagai akseptor elektron, dan mereduksi berbagai senyawa belerang teroksidasi kembali menjadi sulfida, seringkali menjadi hidrogen sulfida. Mereka dapat tumbuh pada senyawa belerang teroksidasi sebagian lainnya (misalnya tiosulfat, tionat, polisulfida, sulfit).
Ada penelitian yang menunjukkan bahwa banyak endapan belerang asli di tempat-tempat yang merupakan dasar lautan purba memiliki asal biologis.[97][98][99] Studi-studi ini menunjukkan bahwa belerang asli ini telah diperoleh melalui aktivitas biologis, tetapi apa yang bertanggung jawab untuk itu (bakteri pengoksidasi belerang atau bakteri pereduksi sulfat) masih belum diketahui secara pasti.
Belerang diserap oleh akar tumbuhan dari tanah sebagai sulfat dan diangkut sebagai ester fosfat. Sulfat direduksi menjadi sulfida melalui sulfit sebelum dimasukkan ke dalam sisteina dan senyawa organobelerang lainnya.[100]
- SO42− → SO32− → H2S → sisteina (tiol) → metionina (tioeter)
Peran tumbuhan dalam mentransfer belerang ke hewan melalui rantai makanan kurang lebih telah dipahami, sementara peran bakteri belerang baru saja diselidiki.[101][102]
Metabolit organik dan protein
[sunting | sunting sumber]Dalam semua bentuk kehidupan, sebagian besar belerang terkandung dalam dua asam amino proteinogenik (sisteina dan metionina), sehingga unsur tersebut terdapat dalam semua protein yang mengandung asam amino ini, serta dalam peptida masing-masing.[103] Beberapa belerang terdiri dari metabolit tertentu — banyak di antaranya adalah kofaktor, — dan polisakarida sulfat dari jaringan ikat (kondroitin sulfat, heparin).
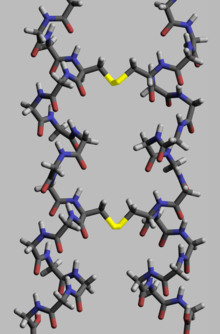
Protein, untuk menjalankan fungsi biologisnya, perlu memiliki geometri ruang yang spesifik. Pembentukan geometri ini dilakukan dalam proses yang disebut pelipatan protein, dan disediakan oleh ikatan intra- dan antar- molekul. Proses tersebut memiliki beberapa tahapan. Pada tahap awal, rantai polipeptida terlipat karena ikatan hidrogen, sementara pada tahap selanjutnya terjadi pelipatan (terlepas dari ikatan hidrogen) melalui ikatan kovalen antara dua atom belerang dari dua residu sisteina (disebut jembatan disulfida) pada tempat rantai yang berbeda (struktur protein tersier) serta antara dua residu sisteina dalam dua subunit protein yang terpisah (struktur protein kuaterner). Kedua struktur dengan mudah dapat dilihat pada insulin. Karena energi ikatan jembatan kovalen disulfida lebih tinggi daripada energi ikatan koordinasi atau interaksi hidrofilik atau hidrofobik, kandungan jembatan disulfida yang lebih tinggi mengarah pada energi yang lebih tinggi yang dibutuhkan untuk denaturasi protein. Secara umum ikatan disulfida diperlukan dalam protein yang berfungsi di luar ruang seluler, dan mereka tidak mengubah konformasi (geometri) protein, tetapi berfungsi sebagai penstabilnya.[104] Di dalam sitoplasma, residu sisteina dari protein disimpan dalam keadaan tereduksi (yaitu dalam bentuk -SH) oleh tioredoksin.[105]
Properti ini terwujud dalam contoh berikut. Lisozim cukup stabil untuk digunakan sebagai obat.[106] Bulu dan rambut memiliki kekuatan relatif, dan mengandung keratin di dalamnya dianggap tidak dapat dicerna oleh sebagian besar organisme. Namun, ada jamur dan bakteri yang mengandung keratinase, dan mampu merusak keratin.
Banyak enzim seluler penting menggunakan gugus prostetik yang diakhiri dengan gugus -SH untuk menangani reaksi yang melibatkan biokimia yang mengandung asil: dua contoh umum dari metabolisme dasar adalah koenzim A dan asam alfa-lipoat.[107] Metabolit yang berhubungan dengan sisteina, homosisteina dan taurina, adalah asam amino lain yang mengandung belerang yang memiliki struktur serupa, tetapi tidak dikodekan oleh DNA, dan bukan bagian dari struktur utama protein, mengambil bagian dalam berbagai lokasi fisiologi mamalia.[108][109] Dua dari 13 vitamin klasik, biotin dan tiamina, mengandung belerang, dan berfungsi sebagai kofaktor beberapa enzim.[110][111]
Dalam kimia intraseluler, belerang beroperasi sebagai pembawa hidrogen pereduksi dan elektronnya untuk perbaikan oksidasi seluler. Glutationa tereduksi, tripeptida yang mengandung belerang, adalah agen pereduksi melalui gugus sulfhidril (-SH) yang berasal dari sisteina.
Metanogenesis, rute menuju sebagian besar metana dunia, adalah transformasi biokimia karbon dioksida bertahap. Konversi ini membutuhkan beberapa kofaktor organobelerang. Contohnya adalah koenzim M, CH3SCH2CH2SO3−, prekursor langsung dari metana.[112]
Metaloprotein dan kofaktor anorganik
[sunting | sunting sumber]Metaloprotein — di mana sisi aktifnya adalah ion logam transisi (atau gugus logam-sulfida) yang sering dikoordinasikan oleh atom belerang dari residu sisteina[113] — merupakan komponen esensial dari enzim yang terlibat dalam proses transfer elektron. Contohnya adalah plastosianin (Cu2+) dan reduktase dinitrogen monoksida (Cu–S). Fungsi enzim ini bergantung pada fakta bahwa ion logam transisi dapat mengalami reaksi redoks. Contoh lainnya adalah banyak protein seng,[114] serta gugus besi–belerang. Yang paling meresap adalah ferodoksin, yang berfungsi sebagai angkutan elektron dalam sel. Pada bakteri, enzim nitrogenase yang penting mengandung gugus Fe–Mo–S dan merupakan katalis yang melakukan fungsi penting pengikatan nitrogen, mengubah nitrogen atmosfer menjadi amonia yang dapat digunakan oleh mikroorganisme dan tumbuhan untuk membuat protein, DNA, RNA, alkaloid, dan senyawa nitrogen organik lainnya yang diperlukan untuk kehidupan.[115]
Kekurangan belerang
[sunting | sunting sumber]Pada manusia, metionina adalah asam amino esensial, serta sisteina merupakan esensial bersyarat dan dapat disintesis dari serin nonesensial (donor belerang akan menjadi metionina dalam kasus ini).
Kekurangan diet jarang terjadi dalam kondisi umum. Kekurangan metionina buatan dicoba untuk diterapkan dalam pengobatan kanker,[116] namun metode tersebut masih berpotensi berbahaya.[117]
Terdapat penyakit genetik fatal yang jarang terjadi terkait dengan kerusakan oksidase sulfit, enzim yang memetabolisme asam amino yang mengandung belerang.[118]
Pencegahan
[sunting | sunting sumber]| Bahaya | |
|---|---|
| Piktogram GHS |  
|
| Keterangan bahaya GHS | {{{value}}} |
| H315[119] | |

Meskipun belerang elemental hanya diserap secara minimal melalui kulit dan memiliki toksisitas rendah pada manusia, menghirup debu belerang atau kontak dengan mata atau kulit dapat menyebabkan iritasi. Menelan belerang secara berlebihan dapat menyebabkan sensasi terbakar atau diare,[121] dan kasus asidosis metabolik yang mengancam jiwa telah dilaporkan setelah pasien dengan sengaja mengonsumsi belerang sebagai obat tradisional.[122][123]
Toksisitas senyawa belerang
[sunting | sunting sumber]Sebagian besar garam sulfat yang larut, seperti garam Epsom, tidaklah beracun. Garam sulfat yang larut akan diserap dengan buruk dan laksatif.[124][125] Ketika disuntikkan secara parenteral, mereka dengan bebas disaring oleh ginjal dan dihilangkan dengan toksisitas yang sangat kecil dalam jumlah multigram.[126] Aluminium sulfat digunakan dalam pemurnian air minum,[127][128] instalasi pengolahan air limbah, dan pembuatan kertas.[129][130]
Ketika belerang terbakar di udara, ia menghasilkan belerang dioksida. Di dalam air, gas ini menghasilkan asam belerang dan sulfit; sulfit adalah antioksidan yang menghambat pertumbuhan bakteri aerob dan bahan tambahan pangan yang bermanfaat dalam jumlah kecil. Pada konsentrasi tinggi, asam ini dapat membahayakan paru-paru, mata, atau jaringan lainnya. Pada organisme tanpa paru-paru seperti serangga atau tumbuhan, sulfit dalam konsentrasi tinggi akan mencegah respirasi.[butuh rujukan]
Belerang trioksida (dibuat dengan katalisis dari belerang dioksida) dan asam sulfat sama-sama sangat asam dan korosif dengan adanya air. Asam sulfat adalah zat dehidrasi kuat yang dapat menghilangkan molekul air yang tersedia dan komponen air dari gula dan jaringan organik.[131]
Pembakaran batu bara dan/atau minyak bumi oleh industri dan pembangkit listrik menghasilkan belerang dioksida (SO2) yang bereaksi dengan air atmosfer dan oksigen untuk menghasilkan asam sulfat (H2SO4) dan asam sulfit (H2SO3). Asam-asam ini adalah komponen hujan asam, menurunkan pH tanah dan air tawar, terkadang mengakibatkan kerusakan besar pada lingkungan dan pelapukan kimia pada patung dan bangunan. Standar bahan bakar semakin mengharuskan produsen bahan bakar mengekstrak belerang dari bahan bakar fosil untuk mencegah pembentukan hujan asam. Belerang yang diekstraksi dan disuling ini mewakili sebagian besar produksi belerang. Di pembangkit listrik tenaga batu bara, gas buang terkadang dimurnikan. Pembangkit listrik yang lebih modern yang menggunakan gas sintetis mengekstrak belerang sebelum membakar gas.
Hidrogen sulfida kira-kira setengah beracunnya seperti hidrogen sianida, dan memabukkan dengan mekanisme yang sama (menghambat enzim pernapasan sitokrom oksidase),[132] meskipun hidrogen sulfida cenderung menyebabkan keracunan mendadak dari jumlah kecil yang terhirup (mendekati batas paparan yang diizinkannya — PEL — sebesar 20 ppm) karena baunya yang tidak mengenakkan.[133] Namun, kehadirannya di udara sekitar pada konsentrasi lebih dari 100-150 ppm dengan cepat mematikan indera penciuman,[134] dan korban dapat bernapas dalam jumlah yang meningkat tanpa disadari sampai gejala yang parah menyebabkan kematian. Garam sulfida dan hidrosulfida terlarut bersifat toksik melalui mekanisme yang sama.
Lihat pula
[sunting | sunting sumber]Referensi
[sunting | sunting sumber]- ^ (Indonesia) "Belerang". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ "Sulfur History". Georgiagulfsulfur.com. Diakses tanggal 18 Juli 2022.
- ^ a b c Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (edisi ke-2), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^
 Chisholm, Hugh, ed. (1911). "Brimstone". Encyclopædia Britannica. 4 (edisi ke-11). Cambridge University Press. hlm. 571.
Chisholm, Hugh, ed. (1911). "Brimstone". Encyclopædia Britannica. 4 (edisi ke-11). Cambridge University Press. hlm. 571.
- ^ a b c d Laurence Knight (19 Juli 2014). "Sulphur surplus: Up to our necks in a diabolical element". BBC.
- ^ a b "Sulfur". Elements. BBC. 11 Oktober 2014.. Unduh di sini.
- ^ Rettig, S. J.; Trotter, J. (15 December 1987). "Refinement of the structure of orthorhombic sulfur, α-S8" (PDF). Acta Crystallographica Section C. 43 (12): 2260–2262. doi:10.1107/S0108270187088152.
- ^ Bau menyengat yang disebut "bau belerang" sebenarnya dikeluarkan oleh beberapa senyawa belerang, seperti senyawa hidrogen sulfida dan organobelerang.
- ^ Tucker, Roy P. (1 Januari 1929). "Notes on the Sublimation of Sulfur between 25° and 50°C". Industrial & Engineering Chemistry (dalam bahasa Inggris). 21 (1): 44–47. doi:10.1021/ie50229a014. ISSN 0019-7866.
- ^ a b c Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, hlm. 645–665, ISBN 0-7506-3365-4
- ^ Maldonado-Zagal, S. B.; Boden, P. J. (1 Januari 1982). "Hydrolysis of Elemental Sulphur in Water and its Effect on the Corrosion of Mild Steel". British Corrosion Journal. 17 (3): 116–120. doi:10.1179/000705982798274336. ISSN 0007-0599. Diakses tanggal 21 Maret 2023.
- ^ Munson, Ronald A. (Februari 1968). "The synthesis of iridium disulfide and nickel diarsenide having the pyrite structure" (PDF). Inorganic Chemistry. 7 (2): 389–390. doi:10.1021/ic50060a047.
- ^ Egon Wiberg; Nils Wiberg (2001). Inorganic Chemistry. Academic Press. hlm. 513–. ISBN 978-0-12-352651-9.
- ^ Steudel, Ralf; Eckert, Bodo (2003). Solid Sulfur Allotropes Sulfur Allotropes. Topics in Current Chemistry. 230. hlm. 1–80. doi:10.1007/b12110. ISBN 978-3-540-40191-9.
- ^ Steudel, R. (1982). "Homocyclic sulfur molecules". Inorganic Ring Systems. Topics in Current Chemistry. 102. hlm. 149–176. doi:10.1007/3-540-11345-2_10. ISBN 978-3-540-11345-4.
- ^ Tebbe, Fred N.; Wasserman, E.; Peet, William G.; Vatvars, Arturs; Hayman, Alan C. (1982). "Composition of Elemental Sulfur in Solution: Equilibrium of S6, S7, and S8 at Ambient Temperatures". Journal of the American Chemical Society. 104 (18): 4971–4972. doi:10.1021/ja00382a050.
- ^ Meyer, Beat (1964). "Solid Allotropes of Sulfur". Chemical Reviews. 64 (4): 429–451. doi:10.1021/cr60230a004.
- ^ Meyer, Beat (1976). "Elemental sulfur". Chemical Reviews. 76 (3): 367–388. doi:10.1021/cr60301a003.
- ^ Sulfur. CIAAW
- ^ Haynes, William M., ed. (2011). CRC Handbook of Chemistry and Physics (edisi ke-92). Boca Raton, FL: CRC Press. hlm. 1.14. ISBN 1439855110.
- ^ "Searching for the Origins of Presolar Grains". Energy.gov (dalam bahasa Inggris). Diakses tanggal 21 Maret 2023.
- ^ Paytan, Adina; Yao, Weiqi; Faul, Kristina; Gray, E.T. (2020). "Sulfur Isotope Stratigraphy". Geologic Time Scale (dalam bahasa Inggris). hlm. 259–278. doi:10.1016/B978-0-12-824360-2.00009-7. ISBN 9780128243602.
- ^ "NASA Astrobiology". astrobiology.nasa.gov (dalam bahasa Inggris). Diakses tanggal 21 Maret 2023.
- ^ Kim, Ik Soo; Kwak, Seung Im; Park, Ul Jae; Bang, Hong Sik; Han, Hyun Soo (1 Juli 2005). "Production of Sulfur-35 by the Cation Exchange Process" (dalam bahasa English).
- ^ "Sulfur-35 (35 S) safety information and specific handling precautions" (PDF). Yale Environmental Health & Safety.
- ^ Cameron, A. G. W. (1957). "Stellar Evolution, Nuclear Astrophysics, and Nucleogenesis" (PDF). CRL-41.
- ^ Mason, B. (1962). Meteorites
 . New York: John Wiley & Sons. hlm. 160. ISBN 978-0-908678-84-6.
. New York: John Wiley & Sons. hlm. 160. ISBN 978-0-908678-84-6.
- ^ Lopes, Rosaly M. C.; Williams, David A. (2005). "Io after Galileo". Reports on Progress in Physics. 68 (2): 303–340. Bibcode:2005RPPh...68..303L. doi:10.1088/0034-4885/68/2/R02.
- ^ Rickwood, P. C. (1981). "The largest crystals" (PDF). American Mineralogist. 66: 885–907.
- ^ Kutney, Gerald (2007). Sulfur: history, technology, applications & industry. Toronto: ChemTec Publications. hlm. 43. ISBN 978-1-895198-37-9. OCLC 79256100.
- ^ C. E. J. de Ronde, W. W. Chadwick Jr, R. G. Ditchburn, R. W. Embley, V. Tunnicliffe, E. T. Baker. S. L. Walker. V. L. Ferrini, dan S. M. Merle (2015): "Molten Sulfur Lakes of Intraoceanic Arc Volcanoes". Bab Volcanic Lakes (Springer), halaman 261-288. DOI:10.1007/978-3-642-36833-2 ISBN 978-3-642-36832-5
- ^ Klein, Cornelis dan Cornelius S. Hurlbut, Jr., Manual of Mineralogy, Wiley, 1985, edisi ke-20, hlm. 265-6 ISBN 0-471-80580-7
- ^ "Sulphur: Mineral information, data and localities". www.mindat.org.
- ^ a b c d e Nehb, Wolfgang; Vydra, Karel (2006). "Sulfur". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag. doi:10.1002/14356007.a25_507.pub2. ISBN 978-3-527-30673-2.
- ^ Shriver, Atkins. Inorganic Chemistry, Fifth Edition. W. H. Freeman dan Company, New York, 2010; hlm. 416
- ^ Fujimori, Toshihiko; Morelos-Gómez, Aarón; Zhu, Zhen; Muramatsu, Hiroyuki; Futamura, Ryusuke; Urita, Koki; Terrones, Mauricio; Hayashi, Takuya; Endo, Morinobu; Young Hong, Sang; Chul Choi, Young; Tománek, David; Kaneko, Katsumi (2013). "Conducting linear chains of sulphur inside carbon nanotubes". Nature Communications. 4: 2162. Bibcode:2013NatCo...4.2162F. doi:10.1038/ncomms3162. PMC 3717502
 . PMID 23851903.
. PMID 23851903.
- ^ Handbook of Preparative Inorganic Chemistry, edisi ke-2. Disunting oleh G. Brauer, Academic Press, 1963, NY. Vol. 1. hlm. 421.
- ^ Hasek, W. R. (1961). "1,1,1-Trifluoroheptane". Org. Synth. 41.
- ^ (1950) "1-Methyl-3-ethyloxindole". Org. Synth. 30.
- ^ Vaughan, D. J.; Craig, J. R. "Mineral Chemistry of Metal Sulfides" Cambridge University Press, Cambridge (1978) ISBN 0-521-21489-0
- ^ a b Cremlyn R. J. (1996). An Introduction to Organosulfur Chemistry. Chichester: John Wiley and Sons. ISBN 0-471-95512-4.
- ^ Wilson, R. W.; Penzias, A. A.; Wannier, P. G.; Linke, R. A. (15 March 1976). "Isotopic abundances in interstellar carbon monosulfide". Astrophysical Journal. 204: L135–L137. Bibcode:1976ApJ...204L.135W. doi:10.1086/182072.
- ^ Banoub, Joseph (2011). Detection of Biological Agents for the Prevention of Bioterrorism. Detection of Biological Agents for the Prevention of Bioterrorism. NATO Science for Peace and Security Series A: Chemistry and Biology. hlm. 183. Bibcode:2011dbap.book.....B. doi:10.1007/978-90-481-9815-3. ISBN 978-90-481-9815-3. OCLC 697506461.
- ^ "Sulfur in the Bible (14 instances)". bible.knowing-jesus.com. Diakses tanggal 19 Mei 2022.
- ^ Rapp, George Robert (4 Februari 2009). Archaeomineralogy. hlm. 242. ISBN 978-3-540-78593-4.
- ^ Odyssey, buku 22, baris 480–495. www.perseus.tufts.edu. Diakses tanggal 21 Maret 2023.
- ^ Pliny the Elder on science and technology, John F. Healy, Oxford University Press, 1999, ISBN 0-19-814687-6, pp. 247–249.
- ^ a b c Zhang, Yunming (1986). "The History of Science Society: Ancient Chinese Sulfur Manufacturing Processes". Isis. 77 (3): 487. doi:10.1086/354207.
- ^ Koch, Rudolf (1955). The book of signs : which contains all manner of symbols used from the earliest times to the Middle Ages by primitive peoples and early Christians. New York. ISBN 0-486-20162-7.
- ^ White, David Gordon (1996). The Alchemical Body — Siddha Traditions in Medieval India. Chicago: University of Chicago Press. hlm. passim. ISBN 978-0-226-89499-7.
- ^ Lin, A. N.; Reimer, R. J.; Carter, D. M. (1988). "Sulfur revisited". Journal of the American Academy of Dermatology. 18 (3): 553–558. doi:10.1016/S0190-9622(88)70079-1. PMID 2450900.
- ^ Maibach, H. I.; Surber, C.; Orkin, M. (1990). "Sulfur revisited". Journal of the American Academy of Dermatology. 23 (1): 154–156. doi:10.1016/S0190-9622(08)81225-X
 . PMID 2365870.
. PMID 2365870.
- ^ Gupta, A. K.; Nicol, K. (2004). "The use of sulfur in dermatology". Journal of Drugs in Dermatology. 3 (4): 427–31. PMID 15303787.
- ^ Gupta, Aditya K; Nicol, Karyn (Jul–Ags 2004). "The Use of Sulfur in Dermatology". J Drugs Dermatol. 3 (4): 427–431. PMID 15303787.
- ^ Donovan, Arthur (1996). Antoine Lavoisier: Science, Administration and Revolution (dalam bahasa Inggris). Cambridge University Press. hlm. 66. ISBN 978-0-521-56672-8.
- ^ Poirier, Jean-Pierre (1998). Lavoisier: Chemist, Biologist, Economist (dalam bahasa Inggris). University of Pennsylvania Press. hlm. 107–8. ISBN 978-0-8122-1649-3.
- ^ Riall, Lucy (1998). Sicily and the Unification of Italy: Liberal Policy and Local Power, 1859–1866. Oxford University Press. ISBN 9780191542619. Diakses tanggal 21 Maret 2023.
- ^ Thomson, D. W. (April 1995). "Prelude to the Sulphur War of 1840: The Neapolitan Perspective". European History Quarterly. 25 (2): 163–180. doi:10.1177/026569149502500201.
- ^ Botsch, Walter (2001). "Chemiker, Techniker, Unternehmer: Zum 150. Geburtstag von Hermann Frasch". Chemie in unserer Zeit (dalam bahasa Jerman). 35 (5): 324–331. doi:10.1002/1521-3781(200110)35:5<324::AID-CIUZ324>3.0.CO;2-9.
- ^ Mass, Jennifer L; Anderson, Mark J (2003). "Pennsylvania German sulfur-inlaid furniture: characterization, reproduction, and ageing phenomena of the inlays". Measurement Science and Technology. 14 (9): 1598. doi:10.1088/0957-0233/14/9/311. ISSN 0957-0233.
- ^ Kogel, Jessica (2006). Industrial minerals & rocks: commodities, markets, and uses (edisi ke-7th). Colorado: Littleton. hlm. 935. ISBN 978-0-87335-233-8. OCLC 62805047.
- ^ "sulphur"
 . Oxford English Dictionary (edisi ke-Online). Oxford University Press. Templat:OEDsub
. Oxford English Dictionary (edisi ke-Online). Oxford University Press. Templat:OEDsub
- ^ "So long sulphur". Nature Chemistry. 1 (5): 333. 4 Agustus 2009. Bibcode:2009NatCh...1Q.333.. doi:10.1038/nchem.301
 . PMID 21378874.
. PMID 21378874.
- ^ McNaught, Alan (1991). "Journal style update". The Analyst. 116 (11): 1094. Bibcode:1991Ana...116.1094M. doi:10.1039/AN9911601094.
- ^ "sulphur – definition of sulphur in English". Oxford Dictionaries. Diarsipkan dari versi asli tanggal 20 November 2016. Diakses tanggal 21 Maret 2023.
- ^ Riegel, Emil; Kent, James (2007). Kent and Riegel's Handbook of Industrial Chemistry and Biotechnology. 1. hlm. 1171. Bibcode:2007karh.book....... ISBN 978-0-387-27842-1. OCLC 74650396.
- ^ Washington, Booker T. (1912). The Man Farthest Down: A Record of Observation and Study in Europe. Doubleday, Page. hlm. 214.
- ^ a b c Eow, John S. (2002). "Recovery of sulfur from sour acid gas: A review of the technology". Environmental Progress. 21 (3): 143–162. doi:10.1002/ep.670210312.
- ^ a b c Schreiner, Bernhard (2008). "Der Claus-Prozess. Reich an Jahren und bedeutender denn je". Chemie in unserer Zeit. 42 (6): 378–392. doi:10.1002/ciuz.200800461.
- ^ Hyndman, A. W.; Liu, J. K.; Denney, D. W. (1982). "Sulfur Recovery from Oil Sands". Sulfur: New Sources and Uses. ACS Symposium Series. 183. hlm. 69–82. doi:10.1021/bk-1982-0183.ch005. ISBN 978-0-8412-0713-4.
- ^ a b Mohamed, Abdel-Mohsen Onsy; El-Gamal, Maisa M. (2010). Sulfur concrete for the construction industry: a sustainable development approach. Fort Lauderdale: J. Ross Publishing. hlm. 104–105, 109. ISBN 978-1-60427-005-1. OCLC 531718953.
- ^ McElvaney, Kevin (25 Februari 2015). "The Men Who Mine Volcanos". The Atlantic. Diakses tanggal 21 Maret 2023.
- ^ Apodaca, Lori E. (2012) Sulfur. Mineral Commodity Summaries. USGS
- ^ a b Apodaca, Lori E. "Mineral Yearbook 2010: Sulfur" (PDF). USGS.
- ^ a b "FAQ - The Sulphur Institute". sulphurinstitute.org. The Sulphur Institute. 2020. Diakses tanggal 22 Maret 2023.
- ^ Zhao, F.; Hawkesford, M. J.; McGrath, S. P. (1999). "Sulphur Assimilation and Effects on Yield and Quality of Wheat". Journal of Cereal Science. 30 (1): 1–17. doi:10.1006/jcrs.1998.0241.
- ^ Blake-Kalff, M. M. A. (2000). "Diagnosing sulfur deficiency in field-grown oilseed rape (Brassica napus L.) and wheat (Triticum aestivum L.)". Plant and Soil. 225 (1/2): 95–107. doi:10.1023/A:1026503812267.
- ^ Ceccotti, S. P. (1996). "Plant nutrient sulphur-a review of nutrient balance, environmental impact and fertilizers". Fertilizer Research. 43 (1–3): 117–125. doi:10.1007/BF00747690.
- ^ Glossary, United States: NASA Earth Observatory, acid rain, diarsipkan dari versi asli tanggal 13 Desember 2011, diakses tanggal 22 Maret 2023
- ^ Every, Richard L.; et al. (20 Agustus 1968). "Method for Preparation of Wettable Sulfur" (PDF). Diakses tanggal 22 Maret 2023.
- ^ Hagers Handbuch der Pharmazeutischen Praxis (dalam bahasa Jerman). 6B (edisi ke-4). Berlin–Heidelberg–New York: Springer. 1978. hlm. 672–9. ISBN 978-3-540-07738-1.
- ^ Arzneibuch-Kommentar. Wissenschaftliche Erläuterungen zum Europäischen Arzneibuch und zum Deutschen Arzneibuch [Komentar Farmakope. Anotasi ilmiah untuk Farmakope Eropa dan Farmakope Jerman] (dalam bahasa Jerman) (edisi ke-23). Stuttgart: Wissenschaftliche Verlagsgesellschaft. 2004. Monographie Schwefel zum äußerlichen Gebrauch [Monografi Belerang untuk pemakaian luar]. ISBN 978-3-8047-2575-1.
- ^ Scott, Kevin A.; Njardarson, Jon T. (2019), Jiang, Xuefeng, ed., "Analysis of US FDA-Approved Drugs Containing Sulfur Atoms" (PDF), Sulfur Chemistry (dalam bahasa Inggris), Springer International Publishing, hlm. 1–34, doi:10.1007/978-3-030-25598-5_1, ISBN 978-3-030-25598-5, diakses tanggal 22 Maret 2023
- ^ Pai, Rahul (10 Februari 2022). "Stabilization of gamma sulfur at room temperature to enable the use of carbonate electrolyte in Li-S batteries". Communications Chemistry. 5 (1): 17. doi:10.1038/s42004-022-00626-2
 . PMC 9814344
. PMC 9814344  Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 36697747 Periksa nilai|pmid=(bantuan). - ^ "Sulphur and the Human Body". The Sulfur Institute. Diakses tanggal 22 Maret 2023.
- ^ "What is the body made of?". New Scientist. Diarsipkan dari versi asli tanggal 3 November 2021. Diakses tanggal 22 Maret 2023.
- ^ Helmenstine, Anne (3 Februari 2019). "Elemental Composition of the Human Body by Mass". ThoughtCo. Diarsipkan dari versi asli tanggal 13 April 2021. Diakses tanggal 22 Maret 2023.
- ^ Parcell, Stephen (Februari 2002). "Sulfur in human nutrition and applications in medicine". Alternative Medicine Review. 7 (1): 22–44. ISSN 1089-5159. PMID 11896744.
- ^ Ingenbleek, Yves; Kimura, Hideo (Juli 2013). "Nutritional essentiality of sulfur in health and disease". Nutrition Reviews. 71 (7): 413–432. doi:10.1111/nure.12050. ISSN 1753-4887. PMID 23815141.
- ^ Dworkin, Martin (Maret 2012). "Sergei Winogradsky: a founder of modern microbiology and the first microbial ecologist". FEMS Microbiology Reviews. 36 (2): 364–379. doi:10.1111/j.1574-6976.2011.00299.x
 . ISSN 1574-6976. PMID 22092289.
. ISSN 1574-6976. PMID 22092289.
- ^ Waksman, S. A.; Starkey, R. L. (20 Januari 1923). "On the Growth and Respiration of Sulfur-Oxidizing Bacteria". The Journal of General Physiology. 5 (3): 285–310. doi:10.1085/jgp.5.3.285. ISSN 0022-1295. PMC 2140527
 . PMID 19871997.
. PMID 19871997.
- ^ Pronk JT; Meulenberg R; Hazeu W; Bos P; Kuenen JG (1990). "Oxidation of reduced inorganic sulphur compounds by acidophilic thiobacilli". FEMS Microbiology Letters. 75 (2–3): 293–306. doi:10.1111/j.1574-6968.1990.tb04103.x
 .
.
- ^ Frigaard, Niels-Ulrik; Dahl, Christiane (1 Januari 2008), Poole, Robert K., ed., Sulfur Metabolism in Phototrophic Sulfur Bacteria, Advances in Microbial Physiology (dalam bahasa Inggris), 54, Academic Press, hlm. 103–200, doi:10.1016/S0065-2911(08)00002-7, ISBN 9780123743237, PMID 18929068, diakses tanggal 22 Maret 2023
- ^ Cavanaugh, Colleen M. (1994). "Microbial Symbiosis: Patterns of Diversity in the Marine Environment". American Zoologist. 34: 79–89. doi:10.1093/icb/34.1.79
 .
.
- ^ Jones, Galen E.; Starkey, Robert L.; Feely, Herbert W.; Kulp, J. Laurence (22 Juni 1956). "Biological Origin of Native Sulfur in Salt Domes of Texas and Louisiana". Science (dalam bahasa Inggris). 123 (3208): 1124–1125. Bibcode:1956Sci...123.1124J. doi:10.1126/science.123.3208.1124. ISSN 0036-8075. PMID 17793426.
- ^ Philip, G.; Wali, A. M. A.; Aref, M. A. M. (1 September 1994). "On the origin of native sulfur deposits in Gebel El Zeit, Gulf of Suez, Egypt". Carbonates and Evaporites (dalam bahasa Inggris). 9 (2): 223–232. doi:10.1007/BF03175232. ISSN 1878-5212.
- ^ "Petrography and mineralogy of the crystalline limestone of Fatha Formation from Mishraq area, Iraq". ResearchGate (dalam bahasa Inggris). Diakses tanggal 22 Maret 2023.
- ^ Heldt, Hans-Walter (1996). Pflanzenbiochemie (dalam bahasa Jerman). Heidelberg: Spektrum Akademischer Verlag. hlm. 321–333. ISBN 978-3-8274-0103-8.
- ^ Kuenen, J. G.; Beudeker, R. F. (13 September 1982). "Microbiology of thiobacilli and other sulphur-oxidizing autotrophs, mixotrophs and heterotrophs". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 298 (1093): 473–497. Bibcode:1982RSPTB.298..473K. doi:10.1098/rstb.1982.0093. ISSN 0962-8436. PMID 6127737.
- ^ Wasmund, Kenneth; Mußmann, Marc; Loy, Alexander (August 2017). "The life sulfuric: microbial ecology of sulfur cycling in marine sediments: Microbial sulfur cycling in marine sediments". Environmental Microbiology Reports (dalam bahasa Inggris). 9 (4): 323–344. doi:10.1111/1758-2229.12538. PMC 5573963
 . PMID 28419734.
. PMID 28419734.
- ^ Gutiérrez-Preciado, A.; Romero, H.; Peimbert, M. (2010). "An Evolutionary Perspective on Amino Acids". Nature Education. 3(9):29.
- ^ Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walter, Peter (2002). Molecular Biology of the Cell. 4th edition (dalam bahasa Inggris). New York: Garland Science. ISBN 978-0-8153-3218-3.
- ^ Arnér, Elias S. J.; Holmgren, Arne (25 Desember 2001). "Physiological functions of thioredoxin and thioredoxin reductase: Thioredoxin and thioredoxin reductase". European Journal of Biochemistry (dalam bahasa Inggris). 267 (20): 6102–6109. doi:10.1046/j.1432-1327.2000.01701.x
 . PMID 11012661.
. PMID 11012661.
- ^ "Lysozyme". Drugs.com (dalam bahasa Inggris). Diakses tanggal 22 Maret 2022.
- ^ Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry
 (edisi ke-3). New York: Worth Publishing. ISBN 978-1-57259-153-0.
(edisi ke-3). New York: Worth Publishing. ISBN 978-1-57259-153-0.
- ^ Selhub, J. (1 Juli 1999). "Homocysteine metabolism". Annual Review of Nutrition. 19 (1): 217–246. doi:10.1146/annurev.nutr.19.1.217. ISSN 0199-9885. PMID 10448523.
- ^ Huxtable, R. J. (1 Januari 1992). "Physiological actions of taurine". Physiological Reviews. 72 (1): 101–163. doi:10.1152/physrev.1992.72.1.101. ISSN 0031-9333. PMID 1731369.
- ^ "The Function of Biotin". www.chem.uwec.edu. Diakses tanggal 22 Maret 2023.
- ^ Edwards, Katie A. "Thiamine Biochemistry". thiamine.dnr.cornell.edu. Diakses tanggal 22 Maret 2023.
- ^ Thauer, R. K. (1998). "Biochemistry of methanogenesis: a tribute to Marjory Stephenson:1998 Marjory Stephenson Prize Lecture". Microbiology. 144 (9): 2377–2406. doi:10.1099/00221287-144-9-2377
 . PMID 9782487.
. PMID 9782487.
- ^ Pace, Nicholas J.; Weerapana, Eranthie (17 April 2014). "Zinc-binding cysteines: diverse functions and structural motifs". Biomolecules. 4 (2): 419–434. doi:10.3390/biom4020419
 . ISSN 2218-273X. PMC 4101490
. ISSN 2218-273X. PMC 4101490  . PMID 24970223.
. PMID 24970223.
- ^ Giles, Niroshini M; Watts, Aaron B; Giles, Gregory I; Fry, Fiona H; Littlechild, Jennifer A; Jacob, Claus (1 Agustus 2008). "Metal and Redox Modulation of Cysteine Protein Function". Chemistry & Biology (dalam bahasa Inggris). 10 (8): 677–693. doi:10.1016/S1074-5521(03)00174-1
 . ISSN 1074-5521. PMID 12954327.
. ISSN 1074-5521. PMID 12954327.
- ^ Lippard, S. J.; Berg, J. M. (1994). Principles of Bioinorganic Chemistry. University Science Books. ISBN 978-0-935702-73-6.
- ^ Mladenović, Dušan; Radosavljević, Tatjana; Hrnčić, Dragan; Rasic-Markovic, Aleksandra; Stanojlović, Olivera (26 Juli 2019). "The effects of dietary methionine restriction on the function and metabolic reprogramming in the liver and brain - implications for longevity". Reviews in the Neurosciences. 30 (6): 581–593. doi:10.1515/revneuro-2018-0073. ISSN 2191-0200. PMID 30817309.
- ^ Binz, Regina L.; Sadhukhan, Ratan; Miousse, Isabelle R.; Garg, Sarita; Koturbash, Igor; Zhou, Daohong; Hauer-Jensen, Martin; Pathak, Rupak (27 Februari 2021). "Dietary Methionine Deficiency Enhances Genetic Instability in Murine Immune Cells". International Journal of Molecular Sciences. 22 (5): 2378. doi:10.3390/ijms22052378
 . ISSN 1422-0067. PMC 7956689
. ISSN 1422-0067. PMC 7956689  . PMID 33673497 Periksa nilai
. PMID 33673497 Periksa nilai |pmid=(bantuan). - ^ Karakas, Erkan; Kisker, Caroline (10 Oktober 2005). "Structural analysis of missense mutations causing isolated sulfite oxidase deficiency". Dalton Transactions (dalam bahasa Inggris) (21): 3459–3463. doi:10.1039/B505789M. ISSN 1477-9234. PMID 16234925.
- ^ "Sulfur 84683". S.
- ^ "Chemical Datasheet. SULFUR, MOLTEN".
- ^ "Sulfur General Fact Sheet". npic.orst.edu. Diakses tanggal 22 Maret 2023.
- ^ Schwartz, Steven M.; Carroll, Hugh M.; Scharschmidt, Linda A. (1 Juli 1986). "Sublimed (Inorganic) Sulfur Ingestion: A Cause of Life-Threatening Metabolic Acidosis With a High Anion Gap". Archives of Internal Medicine. 146 (7): 1437–1438. doi:10.1001/archinte.1986.00360190229034. ISSN 0003-9926. PMID 3718141.
- ^ Blum, J. Eric; Coe, Fredric L. (13 Januari 2010). "Metabolic Acidosis after Sulfur Ingestion". New England Journal of Medicine (dalam bahasa Inggris). 297 (16): 869–870. doi:10.1056/nejm197710202971606. PMID 904661. Diakses tanggal 22 Maret 2023.
- ^ "Formal Toxicity Summary for SULFATE". rais.ornl.gov. Diakses tanggal 22 Maret 2023.
- ^ "Frequently asked questions about elemental sulfur" (PDF). Florida Department of Agriculture and Consumer Services.
- ^ Speight, James G. (3 Juli 2019). "Chemicals from Non-hydrocarbons". Handbook of Petrochemical Processes. Boca Raton: CRC Press. hlm. 375. doi:10.1201/9780429155611. ISBN 978-0-429-15561-1.
- ^ Global Health and Education Foundation (2007). "Conventional Coagulation-Flocculation-Sedimentation". Safe Drinking Water is Essential. National Academy of Sciences. Diarsipkan dari versi asli tanggal 7 Oktober 2007. Diakses tanggal 22 Maret 2023.
- ^ Kvech S, Edwards M (2002). "Solubility controls on aluminum in drinking water at relatively low and high pH". Water Research. 36 (17): 4356–4368. doi:10.1016/S0043-1354(02)00137-9. PMID 12420940.
- ^ Krupińska, Izabela (2 Februari 2020). "Aluminium Drinking Water Treatment Residuals and Their Toxic Impact on Human Health". Molecules. 25 (3): 641. doi:10.3390/molecules25030641
 . ISSN 1420-3049. PMC 7037863
. ISSN 1420-3049. PMC 7037863  . PMID 32024220.
. PMID 32024220.
- ^ Brückle, Irene (September 1993). "The Role of Alum in Historical Papermaking". cool.culturalheritage.org. Diakses tanggal 22 Maret 2023.
- ^ Baker, Colin (1 Maret 2007). "The dehydration of sucrose". Education in Chemistry. Royal Society of Chemistry. Diakses tanggal 22 Maret 2023.
- ^ "Hydrogen Sulfide Toxicity: Practice Essentials, Pathophysiology, Etiology". Medscape. 30 Maret 2017 – via eMedicine.
- ^ Summers, Vincent (8 April 2017). "Hydrogen Sulfide or Hydrogen Cyanide: Which is More Dangerous?". Quirky Science (dalam bahasa Inggris). Diakses tanggal 22 Maret 2023.
- ^ "Hydrogen Sulfide - Hazards | Occupational Safety and Health Administration". www.osha.gov. Diakses tanggal 22 Maret 2023.
Bacaan lebih lanjut
[sunting | sunting sumber]Sigel, Astrid; Freisinger, Eva; Sigel, Roland K.O., ed. (2020). Transition Metals and Sulfur: A Strong Relationship for Life. Guest Editors Martha E Sosa Torres and Peter M.H.Kroneck. Berlin/Boston: de Gruyter. hlm. xlv+455. ISBN 978-3-11-058889-7.
Pranala luar
[sunting | sunting sumber]- (Inggris) Sulfur di The Periodic Table of Videos (Universitas Nottingham)
- (Inggris) Atomic Data for Sulfur, Laboratorium Pengukuran Fisik NIST
- (Inggris) Diagram fase belerang Diarsipkan 23 Februari 2010 di Wayback Machine., Pengantar Kimia untuk Usia 13–17
- (Inggris) Crystalline, liquid and polymerization of sulfur on Vulcano Island, Italy
- (Inggris) Sulfur and its use as a pesticide
- (Inggris) The Sulphur Institute
- (Inggris) Nutrient Stewardship and The Sulphur Institute
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||
- Unsur kimia
- Artikel mengandung teks Sanskerta
- Lang-sa menggunakan parameter kedua yang tidak disebutkan namanya
- Senyawa sulfur
- Belerang
- Kalkogen
- Nonlogam reaktif
- Nonlogam poliatomik
- Bahan kimia pertanian
- Persiapan antijerawat
- Mineral makanan
- Mineral industri
- Polimer anorganik
- Mineral unsur asli
- Mineral orthorombis
- Mineral dalam grup ruang 70
- Bahan bakar piroteknik
- Unsur kimia dengan struktur ortorombus sederhana