Tantalum
73Ta Tantalum | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Kristal tunggal dan kubus tantalum 1 cm3 | ||||||||||||||||||||||||||||||||||||||||||||||||
Garis spektrum tantalum | ||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /tantalum/ | |||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | abu-abu biru | |||||||||||||||||||||||||||||||||||||||||||||||
| Tantalum dalam tabel periodik | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 73 | |||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 6 | |||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-d | |||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | logam transisi | |||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 8, 18, 32, 11, 2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | padat | |||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | 3290 K (3017 °C, 5463 °F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | 5731 K (5458 °C, 9856 °F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Kepadatan mendekati s.k. | 16,69 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| saat cair, pada t.l. | 15 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 36,57 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 753 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | 25,36 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −3, −1, 0, +1, +2, +3, +4, +5 (oksida agak asam) | |||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 1,5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 761 kJ/mol ke-2: 1500 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari atom | empiris: 146 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 170±8 pm | |||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus berpusat badan (bcc)[1] α-Ta | |||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | tetragon[1] β-Ta | |||||||||||||||||||||||||||||||||||||||||||||||
| Kecepatan suara batang ringan | 3400 m/s (suhu 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Ekspansi kalor | 6,3 µm/(m·K) (suhu 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 57,5 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitas listrik | 131 nΩ·m (suhu 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | paramagnetik[2] | |||||||||||||||||||||||||||||||||||||||||||||||
| Suseptibilitas magnetik molar | +154,0×10−6 cm3/mol (293 K)[3] | |||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Young | 186 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Modulus Shear | 69 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Modulus curah | 200 GPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Rasio Poisson | 0,34 | |||||||||||||||||||||||||||||||||||||||||||||||
| Skala Mohs | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||
| Skala Vickers | 870–1200 MPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Skala Brinell | 440–3430 MPa | |||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | Anders G. Ekeberg (1802) | |||||||||||||||||||||||||||||||||||||||||||||||
| Diketahui sebagai unsur kimia yang berbeda oleh | H. Rose (1844) | |||||||||||||||||||||||||||||||||||||||||||||||
| Isotop tantalum yang utama | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Tantalum adalah sebuah unsur kimia dengan lambang Ta dan nomor atom 73. Sebelumnya dikenal sebagai tantalium, ia dinamai dari Tantalus, seorang tokoh dalam mitologi Yunani.[4] Tantalum adalah sebuah logam transisi berwarna biru-kelabu yang sangat keras, ulet, berkilau, dan sangat tahan terhadap korosi. Ia adalah bagian dari golongan logam tahan api, yang banyak digunakan sebagai komponen paduan dengan titik lebur tinggi yang kuat. Ia adalah unsur golongan 5, bersama dengan vanadium dan niobium, dan ia selalu terjadi dalam sumber geologi yang sama bersama dengan niobium yang mirip secara kimiawi, terutama dalam kelompok mineral tantalit, kolumbit dan koltan.
Kelengaian kimia dan titik lebur tantalum yang sangat tinggi membuatnya berharga untuk peralatan laboratorium dan industri seperti bejana reaksi dan tanur vakum. Ia digunakan dalam kapasitor tantalum untuk peralatan elektronik seperti komputer. Ia sedang diteliti untuk digunakan sebagai bahan resonator superkonduktor berkualitas tinggi dalam prosesor kuantum.[5][6] Tantalum dianggap sebagai unsur yang kritis terhadap teknologi oleh Komisi Eropa.[7]
Sejarah
[sunting | sunting sumber]Tantalum ditemukan di Swedia pada tahun 1802 oleh Anders G. Ekeberg, dalam dua sampel mineral – satu dari Swedia dan satu lagi dari Finlandia.[8][9] Setahun sebelumnya, Charles Hatchett telah menemukan kolumbium (sekarang niobium),[10] dan pada tahun 1809 kimiawan Inggris William H. Wollaston membandingkan oksidanya, kolumbit yang memiliki kepadatan 5,918 g/cm3, dengan oksida tantalum, tantalit yang memiliki kepadatan 7,935 g/cm3. Dia menyimpulkan bahwa kedua oksida tersebut, terlepas dari perbedaan kepadatan terukurnya, adalah identik dan mempertahankan nama tantalum.[11] Setelah Friedrich Wöhler membenarkan hasil ini, diperkirakan bahwa kolumbium dan tantalum adalah unsur yang sama. Kesimpulan ini diperdebatkan pada tahun 1846 oleh kimiawan Jerman Heinrich Rose, yang berpendapat bahwa ada dua unsur tambahan dalam sampel tantalit, dan dia menamainya dari nama anak Tantalus: niobium (dari Niobe, dewi air mata), dan pelopium (dari Pelops).[12][13] Unsur yang diduga "pelopium" kemudian diidentifikasi sebagai campuran tantalum dan niobium, dan ditemukan bahwa niobium identik dengan kolumbium yang telah ditemukan pada tahun 1801 oleh Hatchett.
Perbedaan antara tantalum dan niobium didemonstrasikan secara tegas pada tahun 1864 oleh Christian W. Blomstrand,[14] dan Henri É. Deville, serta oleh Louis J. Troost, yang menentukan rumus empiris beberapa senyawanya pada tahun 1865.[14][15] Konfirmasi lebih lanjut datang dari kimiawan Swiss Jean C. de Marignac,[16] pada tahun 1866, yang membuktikan bahwa hanya terdapat dua unsur. Penemuan ini tidak menghentikan para ilmuwan untuk menerbitkan artikel mengenai apa yang disebut ilmenium hingga tahun 1871.[17] De Marignac adalah orang pertama yang menghasilkan bentuk metalik dari tantalum pada tahun 1864, ketika dia mereduksi tantalum klorida dengan memanaskannya dalam atmosfer hidrogen.[18] Penyelidik awal hanya mampu menghasilkan tantalum tidak murni, dan logam tantalum ulet yang relatif murni pertama diproduksi oleh Werner von Bolton di Charlottenburg pada tahun 1903. Kabel yang dibuat dengan tantalum metalik digunakan untuk filamen bola lampu hingga wolfram menggantikannya dalam penggunaan luas.[19]
Nama tantalum berasal dari nama mitologis Tantalus, ayah dari Niobe dalam mitologi Yunani. Dalam ceritanya, dia telah dihukum setelah mati dengan dikutuk berdiri setinggi lutut di dalam air dengan buah sempurna tumbuh di atas kepalanya, di mana keduanya akan menggoda (tantalize) dia selamanya. (Jika dia membungkuk untuk meminum airnya, airnya terkuras di bawah level yang bisa dia capai, dan jika dia meraih buahnya, cabang-cabangnya terlepas dari genggamannya.)[20] Anders Ekeberg menulis "Logam ini saya sebut tantalum ... sebagian dalam kiasan ketidakmampuannya, ketika direndam dalam asam, untuk menyerap apapun dan menjadi jenuh."[21]
Selama beberapa dekade, teknologi komersial untuk memisahkan tantalum dari niobium melibatkan kristalisasi fraksional kalium heptafluorotantalat dari kalium oksipentafluoroniobat monohidrat, sebuah proses yang ditemukan oleh Jean Charles de Marignac pada tahun 1866. Metode ini telah digantikan oleh ekstraksi pelarut dari larutan tantalum yang mengandung fluorida.[15]
Karakteristik
[sunting | sunting sumber]Sifat fisik
[sunting | sunting sumber]Tantalum adalah sebuah logam yang memiliki warna gelap (biru-kelabu),[22] padat, ulet, sangat keras, mudah dibuat, dan sangat konduktif terhadap panas dan listrik. Logam ini terkenal karena ketahanannya terhadap korosi oleh asam; pada kenyataannya, pada suhu di bawah 150 °C tantalum hampir sepenuhnya kebal terhadap serangan air raja yang biasanya agresif. Ia dapat dilarutkan dengan asam fluorida atau larutan asam yang mengandung ion fluorida dan belerang trioksida, serta dengan larutan kalium hidroksida. Titik lebur tantalum yang tinggi yaitu 3017 °C (titik didih 5458 °C) di antara semua unsur hanya terlampaui oleh wolfram, renium dan osmium untuk logam, dan karbon.
Tantalum eksis dalam dua fase kristal, alfa dan beta. Fase alfa relatif ulet dan lunak; ia memiliki struktur kubus berpusat-badan (grup ruang Im3m, konstanta kisi a = 0,33058 nm), kekerasan Knoop 200–400 HN dan resistivitas listrik 15–60 µΩ⋅cm. Fase beta keras dan rapuh; simetri kristalnya adalah tetragon (grup ruang P42/mnm, a = 1,0194 nm, c = 0,5313 nm), kekerasan Knoop 1000–1300 HN dan resistivitas listrik relatif tinggi pada 170–210 µΩ⋅cm. Fase beta bersifat metastabil dan berubah menjadi fase alfa setelah dipanaskan hingga suhu 750–775 °C. Tantalum curah hampir seluruhnya dalam fase alfa, dan fase beta biasanya eksis sebagai film tipis[23] yang diperoleh melalui sputtering magnetron, deposisi uap kimia atau deposisi elektrokimia dari sebuah larutan garam cair eutektik.[24]
Isotop
[sunting | sunting sumber]Tantalum alami terdiri dari dua isotop: 180mTa (0,012%) dan 181Ta (99,988%). 181Ta adalah sebuah isotop stabil. 180mTa (m menunjukkan keadaan metastabil) diperkirakan meluruh dalam tiga cara: transisi isomeris menjadi keadaan dasar 180Ta, peluruhan beta menjadi 180W, atau penangkapan elektron menjadi 180Hf. Namun, radioaktivitas isomer nuklir ini belum pernah teramati, dan hanya batas bawah waktu paruhnya pada 2,0 × 1016 tahun yang telah ditetapkan.[25] Keadaan dasar 180Ta memiliki waktu paruh hanya 8 jam. 180mTa adalah satu-satunya isomer nuklir alami (tidak termasuk nuklida berumur pendek radiogenik dan kosmogenik). Ia juga merupakan isotop primordial paling langka di alam semesta, dengan mempertimbangkan kelimpahan elemental dari tantalum dan kelimpahan isotopik dari 180mTa dalam campuran alami isotop (dan sekali lagi tidak termasuk nuklida berumur pendek radiogenik dan kosmogenik).[26]
Tantalum telah diteliti secara teoretis sebagai bahan "penggaraman" untuk senjata nuklir (kobalt adalah bahan penggaraman hipotetis yang lebih dikenal). Kulit eksternal 181Ta akan diiradiasi oleh fluks neutron berenergi tinggi intensif dari senjata nuklir yang meledak hipotetis. Ini akan mengubah tantalum menjadi isotop radioaktif 182Ta, yang memiliki waktu paruh 114,4 hari dan menghasilkan sinar gama dengan energi sekitar 1,12 juta elektron-volt (MeV) masing-masing, yang secara signifikan akan meningkatkan radioaktivitas luruhan nuklir dari ledakan selama beberapa bulan. Senjata "tergaram" semacam itu tidak pernah dibuat atau diuji, sejauh yang diketahui publik, dan tentunya tidak pernah digunakan sebagai senjata.[27]
Tantalum dapat digunakan sebagai bahan target sinar proton yang dipercepat untuk produksi berbagai isotop berumur pendek termasuk 8Li, 80Rb, dan 160Yb.[28]
Senyawa
[sunting | sunting sumber]Tantalum membentuk senyawa dalam keadaan oksidasi −III hingga +V. Yang paling sering dijumpai adalah oksida Ta(V), yang meliputi semua mineral. Sifat kimia Ta dan Nb sangatlah mirip. Dalam media berair, Ta hanya menunjukkan keadaan oksidasi +V. Seperti niobium, tantalum hampir tidak larut dalam larutan encer asam klorida, sulfat, nitrat, dan fosfat karena pengendapan hidro Ta(V) oksida.[29] Dalam media basa, Ta dapat dilarutkan karena pembentukan spesies polioksontantalat.[30]
Oksida, nitrida, karbida, sulfida
[sunting | sunting sumber]Tantalum pentoksida (Ta2O5) adalah senyawa yang paling penting dari perspektif aplikasi. Terdapat banyak oksida tantalum dalam keadaan oksidasi yang lebih rendah, meliputi banyak struktur cacat, dan sedikit dipelajari atau dicirikan dengan buruk.[31]
Tantalat, senyawa yang mengandung [TaO4]3− atau [TaO3]− sangatlah banyak. Litium tantalat (LiTaO3) mengadopsi struktur perovskit. Lantanum tantalat (LaTaO4) mengandung tetrahedra TaO3−4 yang terisolasi.[32]
Seperti dalam kasus logam tahan api lainnya, senyawa tantalum yang paling dikenal adalah nitrida dan karbida. Tantalum karbida, TaC, seperti wolfram karbida yang lebih umum digunakan, adalah keramik keras yang digunakan dalam alat pemotong. Tantalum(III) nitrida digunakan sebagai insulator film tipis dalam beberapa proses fabrikasi mikroelektronik.[33]
Kalkogenida yang dipelajari paling baik adalah TaS2, sebuah semikonduktor berlapis, seperti yang terlihat pada dikalkogenida logam transisi lainnya. Paduan tantalum–telurium membentuk kuasikristal.[32]
Halida
[sunting | sunting sumber]Tantalum halida memiliki rentang keadaan oksidasi +5, +4, dan +3. Tantalum pentafluorida (TaF5) adalah padatan putih dengan titik lebur 97,0 °C. Anion [TaF7]2- digunakan untuk pemisahannya dari niobium.[34] Klorida TaCl5, yang eksis sebagai dimer, adalah reagen utama dalam sintesis senyawa Ta baru. Ia mudah terhidrolisis menjadi sebuah oksiklorida. Halida yang lebih rendah TaX4 dan TaX3, menampilkan ikatan Ta–Ta.[29][32]
Senyawa organotantalum
[sunting | sunting sumber]Senyawa organotantalum termasuk pentametiltantalum, mencampur alkiltantalum klorida, alkiltantalum hidrida, kompleks alkilidena serta turunan siklopentadienil yang sama.[35][36] Beragam garam dan turunan tersubstitusi telah dikenal dengan heksakarbonil [Ta(CO)6]− dan isosianida terkait.

Keterjadian
[sunting | sunting sumber]
Tantalum diperkirakan membentuk sekitar 1 ppm[37] atau 2 ppm[29] berat kerak Bumi. Terdapat banyak spesies mineral tantalum, tetapi hanya beberapa di antaranya yang sejauh ini digunakan oleh industri sebagai bahan baku: tantalit (rangkaian yang terdiri dari tantalit-(Fe), tantalit-(Mn) dan tantalit-(Mg)), mikrolit (sekarang menjadi nama kelompok), wodginit, euksenit (sebenarnya euksenit-(Y)), dan polykras (sebenarnya polykras-(Y)).[38] Tantalit (Fe, Mn)Ta2O6 adalah mineral yang paling penting untuk ekstraksi tantalum. Tantalit memiliki struktur mineral yang sama dengan kolumbit (Fe, Mn) (Ta, Nb)2O6; ketika terdapat lebih banyak tantalum daripada niobium ia disebut tantalit dan ketika terdapat lebih banyak niobium daripada tantalum ia disebut kolumbit (atau niobit). Kepadatan tinggi dari tantalit dan mineral lain yang mengandung tantalum menjadikan penggunaan pemisahan gravitasi sebagai metode terbaik. Mineral lainnya meliputi samarskit dan fergusonit.
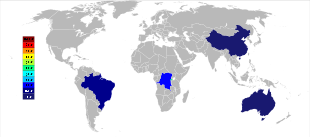
Australia adalah produsen utama tantalum sebelum tahun 2010-an, dengan Global Advanced Metals (sebelumnya dikenal sebagai Talison Minerals) menjadi perusahaan pertambangan tantalum terbesar di negara tersebut. Mereka mengoperasikan dua tambang di Australia Barat, Greenbushes di barat daya dan Wodgina di wilayah Pilbara. Tambang Wodgina dibuka kembali pada Januari 2011 setelah penambangan di lokasi tersebut dihentikan pada akhir 2008 karena krisis keuangan global.[39] Kurang dari setahun setelah dibuka kembali, Global Advanced Metals mengumumkan bahwa lagi-lagi karena "... permintaan tantalum yang melemah ...", dan faktor lainnya, operasi penambangan tantalum akan dihentikan pada akhir Februari 2012.[40] Wodgina memproduksi konsentrat tantalum primer yang ditingkatkan lebih lanjut di operasi Greenbushes sebelum dijual ke pelanggan.[41] Walaupun produsen niobium skala besar berada di Brasil dan Kanada, bijih di sana juga menghasilkan persentase tantalum yang kecil. Beberapa negara lain seperti Tiongkok, Ethiopia, dan Mozambik menambang bijih dengan persentase tantalum yang lebih tinggi, dan mereka menghasilkan persentase yang signifikan dari output dunia. Tantalum juga diproduksi di Thailand dan Malaysia sebagai produk sampingan dari penambangan timah di sana. Selama pemisahan gravitasi bijih dari endapan plaser, tidak hanya kassiterit (SnO2) yang ditemukan, tetapi sebagian kecil tantalit juga termasuk. Terak dari peleburan timah kemudian mengandung sejumlah tantalum yang bermanfaat secara ekonomis, yang terlindi dari terak tersebut.[15][42]
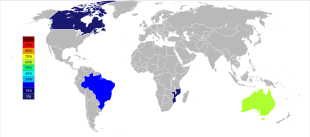
Produksi tambang tantalum dunia telah mengalami pergeseran geografis yang penting sejak awal abad ke-21 ketika produksi sebagian besar berasal dari Australia dan Brasil. Mulai tahun 2007 hingga 2014, sumber utama produksi tantalum dari tambang secara dramatis beralih ke Republik Demokratik Kongo, Rwanda, dan beberapa negara Afrika lainnya.[43] Sumber pasokan tantalum di masa depan, dalam urutan perkiraan ukuran, sedang dieksplorasi di Arab Saudi, Mesir, Greenland, Tiongkok, Mozambik, Kanada, Australia, Amerika Serikat, Finlandia, dan Brasil.[44][45]
Diperkirakan bahwa sumber daya tantalum akan habis sekitar tahun 2060, berdasarkan ekstraksi pada tingkat saat ini, yang menunjukkan perlunya peningkatan daur ulang.[46]
Status sebagai sumber daya konflik
[sunting | sunting sumber]Tantalum dianggap sebagai sebuah sumber daya konflik. Coltan, nama industri untuk mineral kolumbit–tantalit dari mana niobium dan tantalum diekstraksi,[47] juga dapat ditemukan di Afrika Tengah, itulah sebabnya tantalum dikaitkan dengan peperangan di Republik Demokratik Kongo (sebelumnya Zaire). Menurut laporan Perserikatan Bangsa-Bangsa tanggal 23 Oktober 2003,[48] penyelundupan dan ekspor coltan telah membantu mengobarkan perang di Kongo, sebuah krisis yang mengakibatkan sekitar 5,4 juta kematian sejak 1998[49] – menjadikannya konflik terdokumentasi paling mematikan di dunia sejak Perang Dunia II. Pertanyaan etis telah diajukan tentang perilaku perusahaan yang bertanggung jawab, hak asasi manusia, dan satwa liar yang terancam punah, karena eksploitasi sumber daya seperti coltan di wilayah konflik bersenjata di Cekungan Kongo.[50][51][52][53] Survei Geologi Amerika Serikat melaporkan dalam buku tahunannya bahwa wilayah ini menghasilkan kurang dari 1% output tantalum dunia pada tahun 2002–2006, memuncak pada 10% pada tahun 2000 dan 2008.[42] Data USGS yang diterbitkan pada Januari 2021 menunjukkan bahwa hampir 40% produksi tambang tantalum dunia berasal dari Republik Demokratik Kongo, dengan 18% lainnya berasal dari negara tetangganya Rwanda dan Burundi.[54]
Produksi dan fabrikasi
[sunting | sunting sumber]
Beberapa langkah terlibat dalam ekstraksi tantalum dari tantalit. Pertama, mineral tersebut dihancurkan dan dipekatkan melalui pemisahan gravitasi. Proses ini umumnya dilakukan di dekat lokasi tambang.
Pemurnian
[sunting | sunting sumber]Pemurnian tantalum dari bijihnya adalah salah satu proses pemisahan yang lebih menuntut dalam metalurgi industri. Masalah utamanya adalah bijih tantalum mengandung niobium dalam jumlah besar, yang memiliki sifat kimia yang hampir identik dengan Ta. Sejumlah besar prosedur telah dikembangkan untuk mengatasi tantangan ini.
Di zaman modern, pemisahan ini dicapai dengan hidrometalurgi.[56] Ekstraksi dimulai dengan pelindian bijih tersebut dengan asam fluorida bersama dengan asam sulfat atau asam klorida. Langkah ini memungkinkan tantalum dan niobium dipisahkan dari berbagai kotoran nonlogam di dalam batu tersebut. Meskipun Ta terjadi sebagai berbagai mineral, ia mudah direpresentasikan sebagai pentoksida, karena sebagian besar oksida tantalum(V) berperilaku serupa pada kondisi ini. Persamaan yang disederhanakan untuk ekstraksinya adalah sebagai berikut:
- Ta2O5 + 14 HF → 2 H2[TaF7] + 5 H2O
Reaksi yang sepenuhnya analog terjadi untuk komponen niobium, tetapi niobium heksafluorida biasanya dominan pada kondisi ekstraksi.
- Nb2O5 + 12 HF → 2 H[NbF6] + 5 H2O
Kedua persamaan ini telah disederhanakan: diduga bahwa bisulfat (HSO4−) dan klorida bersaing sebagai ligan untuk ion Nb(V) dan Ta(V), ketika masing-masing menggunakan asam sulfat dan asam klorida.[56] Kompleks tantalum dan niobium fluorida kemudian dihilangkan dari larutan berair melalui ekstraksi cair–cair ke dalam pelarut organik, seperti sikloheksanona, oktanol, dan metil isobutil keton. Prosedur sederhana ini memungkinkan penghilangan sebagian besar pengotor yang mengandung logam (misalnya besi, mangan, titanium, zirkonium), yang tetap berada dalam fase berair dalam bentuk fluorida dan kompleks lain mereka.
Pemisahan tantalum dari niobium kemudian dicapai dengan menurunkan kekuatan ionik campuran asam tersebut, yang menyebabkan niobium larut dalam fase berair. Diperkirakan bahwa oksifluorida H2[NbOF5] terbentuk pada kondisi ini. Setelah penghilangan niobium, larutan H2[TaF7] murni dinetralkan dengan amonia encer untuk mengendapkan tantalum oksida terhidrasi sebagai padatan, yang dapat dikalsinasi menjadi tantalum pentoksida (Ta2O5).[57]
Alih-alih hidrolisis, H2[TaF7] dapat diolah dengan kalium fluorida untuk menghasilkan kalium heptafluorotantalat:
- H2[TaF7] + 2 KF → K2[TaF7] + 2 HF
Tidak seperti H2[TaF7], garam kalium tersebut mudah dikristalisasi dan ditangani sebagai padatan.
K2[TaF7] dapat diubah menjadi logam tantalum melalui reduksi dengan natrium, pada suhu sekitar 800 °C dalam garam cair.[58]
- K2[TaF7] + 5 Na → Ta + 5 NaF + 2 KF
Dalam metode yang lebih tua, yang disebut proses Marignac, campuran H2[TaF7] dan H2[NbOF5] diubah menjadi campuran K2[TaF7] dan K2[NbOF5], yang kemudian dipisahkan melalui kristalisasi fraksional, memanfaatkan kelarutan air mereka yang berbeda.
Elektrolisis
[sunting | sunting sumber]Tantalum juga dapat dimurnikan melalui elektrolisis, menggunakan versi modifikasi dari proses Hall–Héroult. Alih-alih membutuhkan oksida input dan logam output dalam bentuk cair, elektrolisis tantalum beroperasi pada oksida bubuk noncair. Penemuan awal datang pada tahun 1997 ketika para peneliti Universitas Cambridge membenamkan sampel kecil oksida tertentu dalam bak garam cair dan mereduksi oksida itu dengan arus listrik. Katodanya menggunakan oksida logam bubuk. Anodanya terbuat dari karbon. Garam cair pada suhu 1.000 °C (1.830 °F) adalah elektrolitnya. Proses pemurnian ini memiliki kapasitas yang cukup untuk memasok 3–4% permintaan global tahunan.[59]
Fabrikasi dan pengerjaan logam
[sunting | sunting sumber]Semua pengelasan tantalum harus dilakukan di dalam atmosfer argon atau helium yang lengai untuk melindunginya dari kontaminasi gas atmosfer. Tantalum tidak dapat disolder. Menggiling tantalum adalah hal yang sulit, terutama untuk tantalum yang teranil. Dalam kondisi teranil, tantalum sangatlah ulet dan dapat dengan mudah dibentuk sebagai lembaran logam.[60]
Aplikasi
[sunting | sunting sumber]Elektronika
[sunting | sunting sumber]
Penggunaan utama tantalum, sebagai bubuk logam, adalah dalam produksi komponen elektronik, terutama kapasitor dan beberapa resistor berdaya tinggi. Kapasitor elektrolit tantalum memanfaatkan kecenderungan tantalum untuk membentuk lapisan permukaan oksida pelindung, menggunakan bubuk tantalum, ditekan menjadi bentuk pelet, sebagai salah satu "pelat" kapasitor, lapisan oksida sebagai dielektrik, dan larutan elektrolitik atau padatan konduktif sebagai "pelat" lainnya. Karena lapisan dielektrik bisa sangat tipis (lebih tipis dari lapisan serupa, misalnya kapasitor elektrolitik aluminium), kapasitansi tinggi dapat dicapai dalam volume kecil. Karena keunggulan ukuran dan beratnya, kapasitor tantalum menarik untuk telepon portabel, komputer pribadi, elektronika otomotif, dan kamera.[61]
Paduan
[sunting | sunting sumber]Tantalum juga digunakan untuk menghasilkan berbagai paduan yang memiliki titik lebur, kekuatan, dan keuletan yang tinggi. Dipadukan dengan logam lain, ia juga digunakan dalam pembuatan alat karbida untuk peralatan pengerjaan logam dan dalam produksi paduan super untuk komponen mesin jet, peralatan proses kimia, reaktor nuklir, bagian misil, penukar panas, tangki, dan bejana.[61][62][63] Karena keuletannya, tantalum dapat ditarik menjadi kawat atau filamen halus, yang digunakan untuk menguapkan logam seperti aluminium. Karena tahan terhadap serangan cairan tubuh dan tidak mengiritasi, tantalum banyak digunakan dalam pembuatan instrumen bedah dan implan. Misalnya, pelapis tantalum berpori digunakan dalam konstruksi implan ortopedi karena kemampuan tantalum untuk membentuk ikatan langsung dengan jaringan keras.[64]
Tantalum bersifat lengai terhadap kebanyakan asam kecuali asam fluorida dan asam sulfat panas, serta larutan alkalin panas juga dapat menyebabkan korosi pada tantalum. Sifat ini menjadikannya logam yang berguna untuk bejana reaksi kimia dan pipa untuk cairan korosif. Kumparan penukar panas untuk pemanasan uap asam klorida dibuat dari tantalum.[65] Tantalum banyak digunakan dalam produksi tabung elektron frekuensi ultra tinggi untuk pemancar radio. Tantalum mampu menangkap oksigen dan nitrogen dengan membentuk nitrida dan oksida dan oleh karena itu membantu mempertahankan vakum tinggi yang dibutuhkan untuk tabung tersebut saat digunakan untuk bagian internal seperti kisi dan pelat.[34][65]
Kegunaan lainnya
[sunting | sunting sumber]
Tantalum digunakan oleh NASA untuk melindungi komponen wahana antariksa, seperti Voyager 1 dan Voyager 2, dari radiasi.[66] Titik lebur dan ketahanan oksidasinya yang tinggi menyebabkan penggunaan logam ini dalam produksi bagian tanur vakum. Tantalum sangat bersifat lengai dan oleh karena itu dibentuk menjadi berbagai bagian tahan korosi, seperti termowel, badan katup, dan pengencang tantalum. Karena kepadatannya yang tinggi, lapisan peledak terarah dan penetrator yang terbentuk secara eksplosif telah dibuat dari tantalum.[67] Tantalum sangat meningkatkan kemampuan penetrasi lapis baja dari peledak terarah karena kepadatannya yang tinggi dan titik leburnya yang tinggi.[68][69]
Ia juga kadang-kadang digunakan dalam jam tangan berharga, misalnya dari Audemars Piguet, F.P. Journe, Hublot, Montblanc, Omega, dan Panerai. Peneliti medis Gerald L. Burke pertama kali mengamati pada tahun 1940 bahwa tantalum juga sangat lengai secara biologis dan dapat digunakan dengan aman sebagai bahan implan ortopedi.[70] Kekakuan tantalum yang tinggi membuatnya perlu untuk digunakan sebagai busa atau perancah yang sangat berpori dengan kekakuan yang lebih rendah untuk implan pengganti pinggul untuk menghindari pelindung stres.[71] Karena tantalum adalah logam nonfero dan nonmagnetik, implan ini dianggap dapat diterima oleh pasien yang menjalani prosedur MRI.[72] Oksidanya digunakan untuk membuat kaca indeks bias tinggi khusus untuk lensa kamera.[73]
Masalah lingkungan
[sunting | sunting sumber]Tantalum mendapat perhatian jauh lebih sedikit di bidang lingkungan daripada di geosains lainnya. Konsentrasi Kerak Atas (UCC) serta rasio Nb/Ta di kerak atas dan mineral tersedia karena pengukuran ini berguna sebagai alat geokimia.[74] Nilai terbaru untuk konsentrasi kerak atas adalah 0,92 ppm, dan rasio Nb/Ta(w/w) adalah 12,7.[75]
Sedikit data yang tersedia pada konsentrasi tantalum dalam kompartemen lingkungan yang berbeda, terutama di perairan alami di mana perkiraan konsentrasi tantalum ‘terlarut’ dalam air laut dan air tawar yang dapat diandalkan bahkan belum diproduksi.[76] Beberapa nilai mengenai konsentrasi terlarut di lautan telah dipublikasikan, tetapi mereka saling bertentangan. Nilai di air tawar sedikit lebih baik, tetapi, dalam semua kasus, mungkin di bawah 1 ng L−1, karena konsentrasi ‘terlarut’ di perairan alami jauh di bawah kemampuan analitik terkini.[77] Analisis memerlukan prosedur prakonsentrasi yang, untuk saat ini, tidak memberikan hasil yang konsisten. Dan bagaimanapun, tantalum tampaknya hadir di perairan alami sebagian besar sebagai partikel alih-alih terlarut.[76]
Nilai konsentrasi dalam tanah, sedimen dasar dan aerosol atmosfer lebih mudah diperoleh.[76] Nilai dalam tanah mendekati 1 ppm dan dengan demikian pula nilai UCC. Ini menunjukkan asal detrital. Untuk aerosol atmosfer, nilai yang tersedia tersebar dan terbatas. Ketika pengayaan tantalum teramati, itu mungkin dikarenakan hilangnya lebih banyak unsur yang larut dalam air dalam aerosol di awan.[78]
Polusi yang terkait dengan penggunaan unsur ini oleh manusia belum terdeteksi.[79] Tantalum tampaknya merupakan unsur yang sangat konservatif dalam istilah biogeokimia, namun siklus dan reaktivitasnya masih belum sepenuhnya dipahami.
Pencegahan
[sunting | sunting sumber]Senyawa yang mengandung tantalum jarang ditemui di laboratorium. Logam ini sangat biokompatibel[70] dan digunakan untuk implan dan pelapis tubuh, oleh karena itu perhatian dapat difokuskan pada unsur lain atau sifat fisik dari senyawa kimianya.[80]
Seseorang dapat terpapar tantalum di tempat kerja dengan menghirupnya, menelannya, serta melalui kontak kulit dan kontak mata. Administrasi Keselamatan dan Kesehatan Kerja (OSHA) telah menetapkan batas legal (batas paparan yang diizinkan) untuk paparan tantalum di tempat kerja sebesar 5 mg/m3 selama 8 jam hari kerja. Institut Nasional untuk Keselamatan dan Kesehatan Kerja (NIOSH) telah menetapkan batas paparan yang direkomendasikan (REL) sebesar 5 mg/m3 selama 8 jam hari kerja dan batas jangka pendek sebesar 10 mg/m3. Pada kadar 2500 mg/m3, debu tantalum langsung berbahaya bagi kehidupan dan kesehatan.[81]
Referensi
[sunting | sunting sumber]- ^ a b Moseley, P. T.; Seabrook, C. J. (1973). "The crystal structure of β-tantalum". Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 29 (5): 1170–1171. doi:10.1107/S0567740873004140.
- ^ Lide, D. R., ed. (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (edisi ke-86). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. hlm. E110. ISBN 0-8493-0464-4.
- ^ Euripides, Orestes
- ^ McLellan, R.A. (2023). "Chemical profiles of the oxides on tantalum in state of the art superconducting circuits". arXiv:2301.04567
 .
.
- ^ Crowley, K.D. (2023). "Disentangling Losses in Tantalum Superconducting Circuits". arXiv:2301.07848
 .
.
- ^ "European Commission (2010). Critical Raw Materials for the EU. Report of the Ad-hoc Working Group on Defining Critical Raw Materials". European Commission. 29 April 2015.
- ^ Ekeberg, Anders (1802). "Of the Properties of the Earth Yttria, compared with those of Glucine; of Fossils, in which the first of these Earths in contained; and of the Discovery of a metallic Nature (Tantalium)". Journal of Natural Philosophy, Chemistry, and the Arts. 3: 251–255.
- ^ Ekeberg, Anders (1802). "Uplysning om Ytterjorden egenskaper, i synnerhet i aemforelse med Berylljorden:om de Fossilier, havari förstnemnde jord innehales, samt om en ny uptäckt kropp af metallik natur". Kungliga Svenska Vetenskapsakademiens Handlingar. 23: 68–83.
- ^ Griffith, William P.; Morris, Peter J. T. (2003). "Charles Hatchett FRS (1765–1847), Chemist and Discoverer of Niobium". Notes and Records of the Royal Society of London. 57 (3): 299–316. doi:10.1098/rsnr.2003.0216. JSTOR 3557720.
- ^ Wollaston, William Hyde (1809). "On the Identity of Columbium and Tantalum". Philosophical Transactions of the Royal Society of London. 99: 246–252. doi:10.1098/rstl.1809.0017. JSTOR 107264.
- ^ Rose, Heinrich (1844). "Ueber die Zusammensetzung der Tantalite und ein im Tantalite von Baiern enthaltenes neues Metall". Annalen der Physik (dalam bahasa Jerman). 139 (10): 317–341. Bibcode:1844AnP...139..317R. doi:10.1002/andp.18441391006.
- ^ Rose, Heinrich (1847). "Ueber die Säure im Columbit von Nordamérika". Annalen der Physik (dalam bahasa Jerman). 146 (4): 572–577. Bibcode:1847AnP...146..572R. doi:10.1002/andp.18471460410.
- ^ a b Marignac, Blomstrand; H. Deville; L. Troost; R. Hermann (1866). "Tantalsäure, Niobsäure, (Ilmensäure) und Titansäure". Fresenius' Journal of Analytical Chemistry. 5 (1): 384–389. doi:10.1007/BF01302537.
- ^ a b c Gupta, C. K.; Suri, A. K. (1994). Extractive Metallurgy of Niobium. CRC Press. ISBN 978-0-8493-6071-8.
- ^ Marignac, M. C. (1866). "Recherches sur les combinaisons du niobium". Annales de Chimie et de Physique (dalam bahasa Prancis). 4 (8): 7–75.
- ^ Hermann, R. (1871). "Fortgesetzte Untersuchungen über die Verbindungen von Ilmenium und Niobium, sowie über die Zusammensetzung der Niobmineralien (Penelitian lebih lanjut mengenai senyawa ilmenium dan niobium, serta komposisi mineral niobium)". Journal für Praktische Chemie (dalam bahasa Jerman). 3 (1): 373–427. doi:10.1002/prac.18710030137.
- ^ "Niobium". Universidade de Coimbra. Diarsipkan dari versi asli tanggal 10 Desember 2007. Diakses tanggal 2 Juli 2023.
- ^ Bowers, B. (2001). "Scanning Our Past from London The Filament Lamp and New Materials". Proceedings of the IEEE. 89 (3): 413. doi:10.1109/5.915382.
- ^ Lempriere, John (1887). Lempriere's Classical Dictionary. hlm. 659.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, hlm. 1138, ISBN 0-7506-3365-4
- ^ Colakis, Marianthe; Masello, Mary Joan (30 Juni 2007). "Tantalum". Classical Mythology & More: A Reader Workbook. ISBN 978-0-86516-573-1.
- ^ Magnuson, M.; Greczynski, G.; Eriksson, F.; Hultman, L.; Hogberg, H. (2019). "Electronic structure of β-Ta films from X-ray photoelectron spectroscopy and first-principles calculations". Applied Surface Science. 470: 607–612. Bibcode:2019ApSS..470..607M. doi:10.1016/j.apsusc.2018.11.096.
- ^ Lee, S.; Doxbeck, M.; Mueller, J.; Cipollo, M.; Cote, P. (2004). "Texture, structure and phase transformation in sputter beta tantalum coating". Surface and Coatings Technology. 177–178: 44. doi:10.1016/j.surfcoat.2003.06.008.
- ^ Hult, Mikael; Wieslander, J. S. Elisabeth; Marissens, Gerd; Gasparro, Joël; Wätjen, Uwe; Misiaszek, Marcin (2009). "Search for the radioactivity of 180mTa using an underground HPGe sandwich spectrometer". Applied Radiation and Isotopes. 67 (5): 918–921. doi:10.1016/j.apradiso.2009.01.057. PMID 19246206.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Win, David Tin; Al Masum, Mohammed (2003). "Weapons of Mass Destruction" (PDF). Assumption University Journal of Technology. 6 (4): 199–219.
- ^ "Tantalum Target Yields - ISAC Yield Database - TRIUMF : Canada's National Laboratory for Particle and Nuclear Physics". mis.triumf.ca.
- ^ a b c Agulyansky, Anatoly (2004). The Chemistry of Tantalum and Niobium Fluoride Compounds. Elsevier. ISBN 978-0-444-51604-6. Diakses tanggal 2 Juli 2023.
- ^ Deblonde, Gauthier J. -P.; Chagnes, Alexandre; Bélair, Sarah; Cote, Gérard (1 Juli 2015). "Solubility of niobium(V) and tantalum(V) under mild alkaline conditions". Hydrometallurgy. 156: 99–106. doi:10.1016/j.hydromet.2015.05.015. ISSN 0304-386X.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (edisi ke-2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ a b c Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (dalam bahasa Jerman) (edisi ke-102). de Gruyter. ISBN 978-3-11-017770-1.
- ^ Tsukimoto, S.; Moriyama, M.; Murakami, Masanori (1961). "Microstructure of amorphous tantalum nitride thin films". Thin Solid Films. 460 (1–2): 222–226. Bibcode:2004TSF...460..222T. doi:10.1016/j.tsf.2004.01.073.
- ^ a b Soisson, Donald J.; McLafferty, J. J.; Pierret, James A. (1961). "Staff-Industry Collaborative Report: Tantalum and Niobium". Ind. Eng. Chem. 53 (11): 861–868. doi:10.1021/ie50623a016.
- ^ Schrock, Richard R. (1 Maret 1979). "Alkylidene complexes of niobium and tantalum". Accounts of Chemical Research. 12 (3): 98–104. doi:10.1021/ar50135a004. ISSN 0001-4842.
- ^ Morse, P. M.; et al. (2008). "Ethylene Complexes of the Early Transition Metals: Crystal Structures of [HfEt4(C2H4)2−] and the Negative-Oxidation-State Species [TaHEt(C2H4)3−3] and [WH(C2H4)3−4]". Organometallics. 27 (5): 984. doi:10.1021/om701189e.
- ^ Emsley, John (2001). "Tantalum". Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, Inggris, UK: Oxford University Press. hlm. 420. ISBN 978-0-19-850340-8.
- ^ "Mines, Minerals and More". Mindat.org.
- ^ "Talison Tantalum eyes mid-2011 Wodgina restart 2010-06-09". Reuters. 9 Juni 2010. Diarsipkan dari versi asli tanggal 19 Januari 2011. Diakses tanggal 2 Juli 2023.
- ^ Emery, Kate (24 Januari 2012). "GAM closes Wodgina tantalum mine". The West Australian. Diarsipkan dari versi asli tanggal 4 Desember 2012. Diakses tanggal 2 Juli 2023.
Permintaan tantalum yang melemah di seluruh dunia dan keterlambatan dalam menerima persetujuan Pemerintah untuk pemasangan peralatan penghancur yang diperlukan merupakan salah satu faktor yang berkontribusi dalam keputusan ini
- ^ "Wodgina Operations". Global Advanced Metals. 2008. Diarsipkan dari versi asli tanggal 6 Oktober 2016. Diakses tanggal 2 Juli 2023.
- ^ a b Papp, John F. (2006). "2006 Minerals Yearbook Nb & Ta". US Geological Survey. Diakses tanggal 2 Juli 2023.
- ^ Bleiwas, Donald I.; Papp, John F.; Yager, Thomas R. (2015). "Shift in Global Tantalum Mine Production, 2000–2014" (PDF). U.S. Geological Survey.
- ^ M. J. (November 2007). "Tantalum supplement" (PDF). Mining Journal. Diarsipkan dari versi asli (PDF) tanggal 10 September 2008. Diakses tanggal 2 Juli 2023.
- ^ "International tantalum resources — exploration and mining" (PDF). GSWA Mineral Resources Bulletin. 22 (10). Diarsipkan dari versi asli (PDF) tanggal 26 September 2007.
- ^ Moyer, Michael (2010). "How much is left?". Scientific American. 303 (3): 74–81. Bibcode:2010SciAm.303c..74M. doi:10.1038/scientificamerican0910-74. PMID 20812483.
- ^ Tantalum-Niobium International Study Center: Coltan Diarsipkan 14 Januari 2016 di Wayback Machine. Diakses tanggal 2 Juli 2023
- ^ "S/2003/1027". 26 Oktober 2003. Diakses tanggal 2 Juli 2023.
- ^ "Special Report: Congo". International Rescue Committee. Diarsipkan dari versi asli tanggal 5 Maret 2012. Diakses tanggal 2 Juli 2023.
- ^ Hayes, Karen; Burge, Richard (2003). Coltan Mining in the Democratic Republic of Congo: How tantalum-using industries can commit to the reconstruction of the DRC. Fauna & Flora. hlm. 1–64. ISBN 978-1-903703-10-6.
- ^ Dizolele, Mvemba Phezo (6 Januari 2011). "Congo's Bloody Coltan". Pulitzer Center on Crisis Reporting. Diakses tanggal 2 Juli 2023.
- ^ "Congo War and the Role of Coltan". Diarsipkan dari versi asli tanggal 13 Juli 2009. Diakses tanggal 2 Juli 2023.
- ^ "Coltan mining in the Congo River Basin". Diarsipkan dari versi asli tanggal 30 Maret 2009. Diakses tanggal 2 Juli 2023.
- ^ United States Geological Survey (Januari 2021). "USGS Mineral Commodities Summary: Tantalum" (PDF). Diakses tanggal 2 Juli 2023.
- ^ "Mineral Resources Program". minerals.usgs.gov. Diarsipkan dari versi asli tanggal 4 Juni 2013.
- ^ a b Zhaowu Zhu; Chu Yong Cheng (2011). "Solvent extraction technology for the separation and purification of niobium and tantalum: A review". Hydrometallurgy. 107 (1–2): 1–12. doi:10.1016/j.hydromet.2010.12.015.
- ^ Agulyanski, Anatoly (2004). Chemistry of Tantalum and Niobium Fluoride Compounds (edisi ke-1). Burlington: Elsevier. ISBN 9780080529028.
- ^ Okabe, Toru H.; Sadoway, Donald R. (1998). "Metallothermic reduction as an electronically mediated reaction". Journal of Materials Research. 13 (12): 3372–3377. Bibcode:1998JMatR..13.3372O. doi:10.1557/JMR.1998.0459.
- ^ "Manufacturing metals: A tantalising prospect". The Economist. 16 Februari 2013. Diakses tanggal 2 Juli 2023.
- ^ "NFPA 484 – Standard for Combustible Metals, Metal Powders, and Metal Dusts – 2002 Edition" (PDF). National Fire Protection Association. NFPA. 13 Agustus 2002. Diakses tanggal 2 Juli 2023.
- ^ a b "Commodity Report 2008: Tantalum" (PDF). United States Geological Survey. Diakses tanggal 2 Juli 2023.
- ^ "Tantalum Products: Tantalum Sheet & Plate | Admat Inc". Admat Inc. (dalam bahasa Inggris). Diarsipkan dari versi asli tanggal 29 Agustus 2018. Diakses tanggal 2 Juli 2023.
- ^ Buckman, R. W. Jr. (2000). "New applications for tantalum and tantalum alloys". JOM: Journal of the Minerals, Metals and Materials Society. 52 (3): 40. Bibcode:2000JOM....52c..40B. doi:10.1007/s11837-000-0100-6.
- ^ Cohen, R.; Della Valle, C. J.; Jacobs, J. J. (2006). "Applications of porous tantalum in total hip arthroplasty". Journal of the American Academy of Orthopaedic Surgeons. 14 (12): 646–55. doi:10.5435/00124635-200611000-00008. PMID 17077337.
- ^ a b Balke, Clarence W. (1935). "Columbium and Tantalum". Industrial and Engineering Chemistry. 20 (10): 1166. doi:10.1021/ie50310a022.
- ^ Bell, Jim (2015). The Interstellar Age: the story of the NASA men and women who flew the forty-year Voyager mission. New York: Dutton. hlm. 110. ISBN 978-0-525-95432-3.
- ^ Nemat-Nasser, Sia; Isaacs, Jon B.; Liu, Mingqi (1998). "Microstructure of high-strain, high-strain-rate deformed tantalum". Acta Materialia. 46 (4): 1307. Bibcode:1998AcMat..46.1307N. doi:10.1016/S1359-6454(97)00746-5.
- ^ Walters, William; Cooch, William; Burkins, Matthew; Burkins, Matthew (2001). "The penetration resistance of a titanium alloy against jets from tantalum shaped charge liners". International Journal of Impact Engineering. 26 (1–10): 823. doi:10.1016/S0734-743X(01)00135-X.
- ^ Russell, Alan M.; Lee, Kok Loong (2005). Structure-property relations in nonferrous metals. Hoboken, NJ: Wiley-Interscience. hlm. 218. ISBN 978-0-471-64952-6.
- ^ a b Burke, Gerald L. (August 1940). "The Corrosion of Metals in Tissues; and An Introduction to Tantalum". Canadian Medical Association Journal. 43 (2): 125–128. PMC 538079
 . PMID 20321780.
. PMID 20321780.
- ^ Black, J. (1994). "Biological performance of tantalum". Clinical Materials. 16 (3): 167–173. doi:10.1016/0267-6605(94)90113-9. PMID 10172264.
- ^ Paganias, Christos G.; Tsakotos, George A.; Koutsostathis, Stephanos D.; Macheras, George A. (2012). "Osseous integration in porous tantalum implants". Indian Journal of Orthopaedics. 46 (5): 505–13. doi:10.4103/0019-5413.101032. ISSN 0019-5413. PMC 3491782
 . PMID 23162141.
. PMID 23162141.
- ^ Musikant, Solomon (1985). "Optical Glass Composition". Optical Materials: An Introduction to Selection and Application. CRC Press. hlm. 28. ISBN 978-0-8247-7309-0.
- ^ Green, TH. (1995). "Significance of Nb/Ta as an indicator of geochemical processes in the crust-mantle system". Chemical Geology. 120 (3–4): 347–359. Bibcode:1995ChGeo.120..347G. doi:10.1016/0009-2541(94)00145-X.
- ^ Hu, Z.; Gao, S. (2008). "Upper crustal abundances of trace elements: a revision and update". Chemical Geology. 253 (3–4): 205. Bibcode:2008ChGeo.253..205H. doi:10.1016/j.chemgeo.2008.05.010.
- ^ a b c Filella, M. (2017). "Tantalum in the environment". Earth-Science Reviews. 173: 122–140. Bibcode:2017ESRv..173..122F. doi:10.1016/j.earscirev.2017.07.002.
- ^ Filella, M.; Rodushkin, I. (2018). "A concise guide for the determination of less-studied technology-critical elements (Nb, Ta, Ga, In, Ge, Te) by inductively coupled plasma mass spectrometry in environmental samples". Spectrochimica Acta Part B. 141: 80–84. Bibcode:2018AcSpe.141...80F. doi:10.1016/j.sab.2018.01.004.
- ^ Vlastelic, I.; Suchorski, K.; Sellegri, K.; Colomb, A.; Nauret, F.; Bouvier, L.; Piro, J-L. (2015). "The high field strength element budget of atmospheric aerosols (puy de Dôme, France)". Geochimica et Cosmochimica Acta. 167: 253–268. Bibcode:2015GeCoA.167..253V. doi:10.1016/j.gca.2015.07.006.
- ^ Filella, M.; Rodríguez-Murillo, JC. (2017). "Less-studied TCE: are their environmental concentrations increasing due to their use in new technologies?". Chemosphere. 182: 605–616. Bibcode:2017Chmsp.182..605F. doi:10.1016/j.chemosphere.2017.05.024. PMID 28525874.
- ^ Matsuno H; Yokoyama A; Watari F; Uo M; Kawasaki T. (2001). "Biocompatibility and osteogenesis of refractory metal implants, titanium, hafnium, niobium, tantalum and rhenium. Biocompatibility of tantalum". Biomaterials. 22 (11): 1253–62. doi:10.1016/S0142-9612(00)00275-1. PMID 11336297.
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Tantalum (metal and oxide dust, as Ta)". www.cdc.gov. Diakses tanggal 2 Juli 2023.
Pranala luar
[sunting | sunting sumber]- (Inggris) Tantalum-Niobium International Study Center
- (Inggris) CDC – NIOSH Pocket Guide to Chemical Hazards
- (Inggris) Laboratorium Nasional Los Alamos - Tantalum
- (Inggris) WebElements.com - Tantalum
| (besar) | |||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
|
| |||||||||||||||||||||||||||||||||



