Tembaga(II) nitrat
| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Tembaga(II) nitrat
| |
| Nama lain
Kuprat nitrat
| |
| Penanda | |
| |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChEBI | |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| Cu(NO3)2 | |
| Massa molar | 187.5558 g/mol (anhidrat) 241.60 g/mol (trihidrat) 232.591 g/mol (hemipentahidrat) |
| Penampilan | kristal biru higroskopis |
| Densitas | 3.05 g/cm3 (anhidrat) 2.32 g/cm3 (trihidrat) 2.07 g/cm3 (heksahidrat) |
| Titik lebur | 256 °C (493 °F; 529 K) (anhidrat, terurai) 114.5 °C (trihidrat) 26.4 °C (heksahidrat, terurai) |
| Titik didih | 170 °C (338 °F; 443 K) (trihidrat, terurai) |
| trihidrat:[1] 381 g/100 mL (40 °C) 666 g/100 mL (80 °C) heksahidrat:[1] 243.7 g/100 mL (80 °C) | |
| Kelarutan | hidrat sangat larut dalam etanol, amonia, air; tak larut dalam etil asetat |
| +1570.0·10−6 cm3/mol (~3H2O) | |
| Struktur | |
| ortorombik (anhidrat) rombohedral (hidrat) | |
| Bahaya | |
| Bahaya utama | Iritan, Pengoksidasi |
| Lembar data keselamatan | Cu(NO3)2·3H2O |
| Batas imbas kesehatan AS (NIOSH): | |
PEL (yang diperbolehkan)
|
TWA 1 mg/m3 (sebagai Cu)[2] |
REL (yang direkomendasikan)
|
TWA 1 mg/m3 (sebagai Cu)[2] |
IDLH (langsung berbahaya)
|
TWA 100 mg/m3 (sebagai Cu)[2] |
| Senyawa terkait | |
Anion lain
|
Tembaga(II) sulfat Tembaga(II) klorida |
Kation lainnya
|
Nikel(II) nitrat Seng nitrat |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Tembaga(II) nitrat, Cu(NO3)2, adalah suatu senyawa anorganik yang membentuk padatan kristalin berwarna biru. Tembaga nitrat anhidrat membentuk kristal berwarna biru gelap-hijau dan menyublim dalam suasana vakum pada suhu 150-200 °C.[3] Tembaga nitrat juga terdapat sebagai lima hidrat yang berbeda, yang paling umum adalah trihidrat dan heksahidrat. Material ini lebih sering ditemui dalam perdagangan daripada di laboratorium.[4]
Sintesis dan reaksi
[sunting | sunting sumber]
Tembaga nitrat terhidrasi dapat disiapkan melalui hidrasi material anhidratnya atau dengan mereaksikan logam tembaga dengan suatu larutan berair dari perak nitrat atau asam nitrat pekat:[4]
- Cu + 4 HNO3 → Cu(NO3)2 + 2 H2O + 2 NO2
Cu(NO3)2 anhidrat terbentuk ketika logam tembaga direaksikan dengan N2O4:[4]
- Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
Percobaan dalam dehidrasi tembaga(II) nitrat hidrat dengan pemanasan akan menghasilkan oksida tembaga, dan bukan Cu(NO3)2. Pada suhu 80 °C, hidratnya akan berubah menjadi "tembaga nitrat basa" (Cu2(NO3)(OH)3), yang berubah menjadi CuO pada suhu 180 °C.[4] Mengeksploitasi reaktivitas ini, tembaga nitrat dapat digunakan untuk menghasilkan asam nitrat dengan memanaskannya hingga terurai dan mengalirkan asapnya langsung ke dalam air. Metode ini mirip dengan tahap terakhir dalam proses Ostwald. Persamaannya adalah sebagai berikut:[4]
- 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
- 3NO2 + H2O → 2HNO3 + NO
Tembaga nitrat basa alami termasuk mineral langka gerhardtite dan rouaite, keduanya merupakan polimorf Cu2(NO3)(OH)3.[5]
Struktur
[sunting | sunting sumber]Tembaga(II) nitrat anhidrat
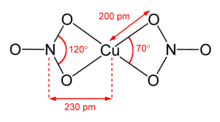
[sunting | sunting sumber]Tembaga(II) nitrat anhidrat telah dikristalisasi dalam dua polimorf bebas-solvat.[6][7] α- dan β-Cu(NO3)2 merupakan jaringan polimer koordinasi 3D penuh. Bentuk alfa hanya memiliki satu lingkungan Cu, dengan koordinasi [4 + 1], tetapi bentuk beta memiliki dua pusat tembaga yang berbeda, satu dengan [4 + 1] dan satu yang berbentuk bujur sangkar. Pelarut nitrometana juga memiliki fitur "koordinasi [4 + 1]", dengan empat ikatan Cu-O pendek sekitar 200 pm dan satu ikatan lagi pada 240 pm.[8] Mereka adalah polimer koordinasi, dengan rantai tembaga(II) dan gugus nitrat tak terbatas. Dalam fase gas, tembaga(II) nitrat menonjolkan dua ligan bidentat nitrat.[9]
Tembaga(II) nitrat hidrat
[sunting | sunting sumber]Lima hidrat dari senyawa ini telah dilaporkan: monohidrat (Cu(NO3)2·H2O),[7] seskuihidrat (Cu(NO3)2·1.5H2O),[10] hemipentahidrat (Cu(NO3)2·2.5H2O),[11] trihidrat (Cu(NO3)2·3H2O),[12] dan heksahidrat ([Cu(H2O)6](NO3)2).[13]
Aplikasi
[sunting | sunting sumber]Tembaga(II) nitrat digunakan dalam berbagai aplikasi, diantaranya adalah ketika dikonversi menjadi tembaga(II) oksida, ia digunakan sebagai katalis untuk berbagai proses dalam kimia organik. Larutannya digunakan dalam tekstil dan agen pemoles untuk logam lain. Tembaga nitrat ditemukan dalam beberapa piroteknik.[4] Senyawa ini sering digunakan di laboratorium sekolah untuk menunjukkan reaksi kimia sel volta. Senyawa ini juga merupakan komponen dalam beberapa keramik glasir dan patina logam.[14]
Sintesis organik
[sunting | sunting sumber]Tembaga nitrat, dalam kombinasi dengan anhidrida asetat, adalah pereaksi efektif untuk nitrasi senyawa aromatik, dalam kondisi yang dikenal sebagai "kondisi Menke", untuk menghormati ahli kimia Belanda yang menemukan bahwa nitrat logam merupakan pereaksi yang efektif untuk nitrasi.[15]
Nitrat tembaga terhidrasi yang diadsorpsi ke tanah liat menghasilkan pereaksi yang disebut "Claycop". Tanah liat berwarna biru yang dihasilkan digunakan sebagai bubur, misalnya untuk oksidasi tiol menjadi disulfida. Claycop juga digunakan untuk mengubah ditioasetal menjadi karbonil.[16] Pereaksi terkait berbasis montmorilonit telah terbukti berguna bagi nitrasi senyawa aromatik.[17]
Referensi
[sunting | sunting sumber]- ^ a b Perrys' Chem Eng Handbook, 7th Ed
- ^ a b c "NIOSH Pocket Guide to Chemical Hazards #0150". National Institute for Occupational Safety and Health (NIOSH).
- ^ Pass and Sutcliffe (1968). Practical Inorganic Chemistry. London: Chapman and Hall.
- ^ a b c d e f H.Wayne Richardson "Copper Compounds" Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a07_567.
- ^ Mindat, http://www.mindat.org/min-10588.html
- ^ Wallwork, S. C.; Addison, W. E. (1965). "The crystal structures of anhydrous nitrates and their complexes. Part I. The α form of copper(II) nitrate". J. Chem. Soc. 1965: 2925–2933. doi:10.1039/JR9650002925.
- ^ a b Troyanov, S. I.; Morozov, I. V.; Znamenkov, K. O.; Yu; Korenev, M. (1995). "Synthesis and X-Ray Structure of New Copper(II) Nitrates: Cu(NO3)2·H2O and ?-modification of Cu(NO3)2". Z. Anorg. Allg. Chem. 621: 1261–1265. doi:10.1002/zaac.19956210727.
- ^ Duffin, B.; Wallwork, S. C. (1966). "The crystal structure of anhydrous nitrates and their complexes. II. The 1:1 copper(II) nitrate-nitromethane complex". Acta Crystallographica. 20: 210–213. doi:10.1107/S0365110X66000434.
- ^ LaVilla, R. E.; Bauer, S. H. (1963). "The Structure of Gaseous Copper(II) Nitrate as Determined by Electron Diffraction". J. Am. Chem. Soc. 85: 3597–3600. doi:10.1021/ja00905a015.
- ^ Dornberger-Schiff, K.; Leciejewicz, J. (1958). "Zur Struktur des Kupfernitrates Cu(NO3)2.1.5H2O". Acta Crystallogr. 11: 825–826. doi:10.1107/S0365110X58002322.
- ^ Morosin, B. (1970). "The crystal structure of Cu(NO3)2.2.5H2O". Acta Crystallogr. B26: 1203–1208. doi:10.1107/S0567740870003898.
- ^ J. Garaj, Sbornik Prac. Chem.-Technol. Fak. Svst., Cskosl. 1966, pp. 35–39.
- ^ Zibaseresht, R.; Hartshorn, R. M. (2006). "Hexaaquacopper(II) dinitrate: absence of Jahn-Teller distortion". Acta Crystallogr. E62: i19–i22. doi:10.1107/S1600536805041851.
- ^ V. Hayez, T. Segato, A. Hubin, H. Terryn (2006). "Study of copper nitrate‐based patinas". Special Issue: Raman Spectroscopy in Art and Archaeology II. 37 (10): 1211–1220. doi:10.1002/jrs.1591.
- ^ Menke J.B. (1925). "Nitration with nitrates". Recueil des Travaux Chimiques des Pays-Bas. 44: 141. doi:10.1002/recl.19250440209.
- ^ Balogh, M. "Copper(II) Nitrate–K10 Bentonite Clay" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289.
- ^ Collet, Christine (1990). "Clays Direct Aromatic Nitration". Angewandte Chemie International Edition in English. 29: 535–536. doi:10.1002/anie.199005351.
Pranala luar
[sunting | sunting sumber]- (Inggris) National Pollutant Inventory – Copper and compounds fact sheet
- (Inggris) ICSC Copper and compounds fact sheet
| HNO3 | He | ||||||||||||||||||
| LiNO3 | Be(NO''"; | B(NO''"; | C | N | O | FNO3 | Ne | ||||||||||||
| NaNO3 | Mg(NO''"; | Al(NO''"; | Si | P | S | ClONO2 | Ar | ||||||||||||
| KNO3 | Ca(NO''"; | Sc(NO''"; | Ti(NO''"; | VO(NO''"; | Cr(NO''"; | Mn(NO''"; | Fe(NO''"; | Co(NO''";, Co(NO''"; |
Ni(NO''"; | Cu(NO''"; | Zn(NO''"; | Ga(NO''"; | Ge | As | Se | Br | Kr | ||
| RbNO | Sr(NO''"; | Y | Zr(NO''"; | Nb | Mo | Tc | Ru | Rh | Pd(NO''"; | AgNO | Cd(NO''"; | In | Sn | Sb | Te | I | Xe(NO''"; | ||
| CsNO | Ba(NO''"; | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg, Hg(NO''"; |
Tl(NO''"; | Pb(NO''"; | Bi(NO''"; | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo | |||
| ↓ | |||||||||||||||||||
| La | Ce(NO''";, Ce(NO''"; |
Pr | Nd | Pm | Sm | Eu | Gd(NO''"; | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
