Penghambat penyerapan kembali serotonin-norepinefrin
| Penghambat penyerapan kembali serotonin-norepinefrin | |
|---|---|
| Kelas obat-obatan | |
 Duloksetin, salah satu anggota SNRI. | |
| Pengenal kelas | |
| Sinonim | Penghambat penyerapan kembali serotonin-noradrenalin selektif; SNaRI |
| Penggunaan | Depresi; kegelisahan; nyeri; kegemukan; gejala menopause |
| Target biologis | Pengangkut serotonin; Pengangkut norepinefrin |
| Pranala luar | |
| MeSH | D000068760 |
| Dalam Wikidata | |
Penghambat penyerapan kembali serotonin-norepinefrin (Bahasa Inggiris: Serotonin–norepinephrine reuptake inhibitor, disingkat SNRI) adalah golongan obat antidepresan yang digunakan untuk mengobati gangguan depresi mayor (MDD), gangguan kecemasan, fobia sosial, nyeri neuropatik kronis, sindrom fibromialgia (FMS), dan gejala menopause. Penggunaan di luar label meliputi pengobatan untuk gangguan pemusatan perhatian dan hiperaktivitas (ADHD), dan gangguan obsesif kompulsif (OCD).[1] SNRI adalah penghambat penyerapan kembali monoamina; khususnya mereka menghambat penyerapan kembali serotonin dan norepinefrin. Neurotransmiter ini dianggap memainkan peran penting dalam pengaturan suasana hati. SNRI dapat dikontraskan dengan penghambat penyerapan kembali serotonin selektif (SSRI) dan penghambat penyerapan kembali norepinefrin (NRI), yang bekerja pada neurotransmiter tunggal.[2]
Pengangkut serotonin manusia (SERT) dan pengangkut norepinefrin (NAT) adalah protein transpor membran yang bertanggung jawab atas penyerapan kembali serotonin dan noradrenalin dari celah sinaptik kembali ke terminal saraf presinaptik. Penghambatan ganda penyerapan kembali serotonin dan noradrenalin dapat memberikan keuntungan dibandingkan obat antidepresan lain dengan mengobati berbagai gejala yang lebih luas.[3] Obat-obatan ini dapat sangat berguna untuk nyeri kronis atau neuropatik yang terjadi bersamaan.[4]
SNRI, bersama dengan SSRI dan NRI, adalah antidepresan generasi kedua. Sejak diperkenalkan pada akhir tahun 1980-an, antidepresan generasi kedua sebagian besar telah menggantikan antidepresan generasi pertama, seperti antidepresan trisiklik (TCA) dan penghambat oksidase monoamina (MAOI), sebagai obat pilihan untuk pengobatan MDD karena tolerabilitas dan profil keamanannya yang lebih baik.[5]
Sejarah
[sunting | sunting sumber]Pada tahun 1952, iproniazid, suatu agen antimikobakteri, ditemukan memiliki sifat psikoaktif saat diteliti sebagai pengobatan yang mungkin untuk tuberkulosis. Para peneliti mencatat bahwa pasien yang diberi iproniazid menjadi ceria, lebih optimis, dan lebih aktif secara fisik. Segera setelah pengembangannya, iproniazid dan zat terkait terbukti memperlambat pemecahan enzimatik serotonin, dopamin, dan norepinefrin melalui penghambatan enzim oksidase monoamina. Karena alasan ini, kelas obat ini dikenal sebagai penghambat oksidase monoamina (MAOI). Selama waktu ini pengembangan agen antidepresan yang sangat berbeda juga diteliti. Imipramin menjadi antidepresan trisiklik (TCA) pertama yang berguna secara klinis. Imipramin ditemukan memengaruhi banyak sistem neurotransmiter dan menghalangi penyerapan kembali norepinefrin dan serotonin dari sinapsis, sehingga meningkatkan kadar neurotransmiter ini. Penggunaan MAOI dan TCA memberikan kemajuan besar dalam pengobatan depresi, tetapi penggunaannya dibatasi oleh efek samping yang tidak menyenangkan dan masalah keamanan dan toksisitas yang signifikan.[6]
Sepanjang tahun 1960-an dan 1970-an, hipotesis katekolamina tentang emosi dan hubungannya dengan depresi menjadi perhatian luas dan bahwa penurunan kadar neurotransmiter tertentu seperti norepinefrin, serotonin, dan dopamin mungkin berperan dalam patogenesis depresi. Hal ini menyebabkan pengembangan fluoksetin, SSRI pertama. Profil keamanan dan tolerabilitas SSRI yang lebih baik pada pasien dengan MDD, dibandingkan dengan TCA dan MAOI, merupakan kemajuan penting lainnya dalam pengobatan depresi.[6]
Sejak akhir tahun 1980-an, SSRI telah mendominasi pasar obat antidepresan. Saat ini, ada peningkatan minat pada obat antidepresan dengan mekanisme aksi yang lebih luas yang dapat menawarkan peningkatan dalam kemanjuran dan tolerabilitas. Pada tahun 1993, obat baru diperkenalkan ke pasar AS yang disebut venlafaksin, suatu penghambat penyerapan kembali serotonin-norepinefrin.[7] Venlafaksin adalah senyawa pertama yang dideskripsikan dalam kelas baru zat antidepresan yang disebut feniletilamin. Zat-zat ini tidak terkait dengan TCA dan SSRI lainnya. Venlafaksin memblokir penyerapan kembali neuronal serotonin, noradrenalin; dan pada tingkat yang lebih rendah, dopamin di sistem saraf pusat. Berbeda dengan beberapa obat antidepresan lainnya, venlafaksin dapat menginduksi onset aksi yang cepat terutama karena penghambatan penyerapan kembali norepinefrin berikutnya.[8] Lihat garis waktu pada gambar 1.

Medikasi
[sunting | sunting sumber]
Ada delapan SNRI yang disetujui FDA di Amerika Serikat, dengan venlafaksin menjadi obat pertama yang dikembangkan pada tahun 1993 dan levomilnacipran menjadi obat terbaru yang dikembangkan pada tahun 2013. Obat-obatan tersebut bervariasi berdasarkan penggunaan medis lainnya, struktur kimia, efek samping, dan kemanjurannya.[9]
| Nama obat | Nama merek | Indikasi FDA | Tahun persetujuan | Struktur kimia | Catatan |
|---|---|---|---|---|---|
| Desvenlafaksin[10] | Pristiq
Khedezla (ER) |
|
2007 |  |
Metabolit aktif dari venlafaksin. Obat ini diyakini bekerja dengan cara yang sama, meskipun beberapa bukti menunjukkan tingkat respons yang lebih rendah dibandingkan dengan venlafaksin dan duloksetin. Obat ini diperkenalkan oleh Wyeth pada bulan Mei 2008, dan saat itu merupakan SNRI ketiga yang disetujui.[11] |
| Duloksetin[12] | Cymbalta
Irenka |
|
2004 |  |
Disetujui untuk pengobatan depresi dan nyeri neuropatik pada bulan Agustus 2004. Duloksetin dikontraindikasikan pada pasien dengan konsumsi alkohol berat atau penyakit hati kronis, karena duloksetin dapat meningkatkan kadar enzim hati tertentu yang dapat menyebabkan hepatitis akut atau penyakit lain pada pasien berisiko tertentu. Risiko kerusakan hati tampaknya hanya terjadi pada pasien yang sudah berisiko, tidak seperti antidepresan nefazodon, yang (meskipun jarang) dapat secara spontan menyebabkan gagal hati pada pasien yang sehat.[16] Duloksetin juga disetujui untuk gangguan depresi mayor (MDD), gangguan kecemasan menyeluruh (GAD), neuropati diabetik, nyeri muskuloskeletal kronis, termasuk nyeri osteoartritis kronis dan nyeri punggung bawah kronis.[14] Duloksetin juga mengalami metabolisme hati dan telah terbukti menyebabkan penghambatan enzim sitokrom P450 hati CYP 2D6.[17] Perhatian harus diberikan saat mengonsumsi Duloksetin dengan obat lain yang dimetabolisme oleh CYP 2D6 karena dapat memicu potensi interaksi obat.[17] |
| Levomilnacipran | Fetzima |
|
2013 | 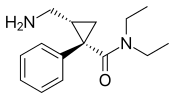 |
Isomer levorotasi milnacipran. Sedang dikembangkan untuk pengobatan depresi di Amerika Serikat dan Kanada, obat ini telah disetujui oleh FDA untuk pengobatan MDD pada bulan Juli 2013. |
| Milnacipran | Ixel Savella Impulsor |
|
1996 |  |
Terbukti sangat efektif dalam pengobatan depresi dan fibromyalgia.[18] |
| Sibutramina | Meridia | 1997 |  |
Bukannya dikembangkan untuk pengobatan depresi, dipasarkan secara luas sebagai penekan nafsu makan untuk tujuan penurunan berat badan. Sibutramin adalah obat pertama untuk pengobatan obesitas yang disetujui dalam 30 tahun.[20] Obat ini telah dikaitkan dengan meningkatnya kejadian kardiovaskular dan strok dan telah ditarik dari pasaran di beberapa negara dan kawasan termasuk Amerika Serikat pada tahun 2010.[21] | |
| Tramadol | Ultram |
|
1977 | 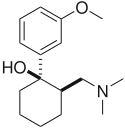 |
Opioid lemah ganda dan SNRI. Obat ini disetujui oleh FDA pada tahun 1995, meskipun telah dipasarkan di Jerman sejak tahun 1977. Obat ini digunakan untuk mengobati nyeri akut dan kronis. Obat ini telah menunjukkan keefektifannya dalam pengobatan fibromialgia, meskipun tidak secara khusus disetujui untuk tujuan ini. Obat ini juga sedang diselidiki sebagai antidepresan dan untuk pengobatan nyeri neuropatik. Obat ini terkait dalam struktur kimia dengan venlafaksin. Karena merupakan opioid, ada risiko penyalahgunaan dan kecanduan; tetapi obat ini memiliki potensi penyalahgunaan, depresi pernapasan, dan konstipasi yang lebih rendah dibandingkan dengan opioid lain seperti hidrokodon, oksikodon, dll.[22] |
| Venlafaksin | Effexor |
|
1994 |  |
SNRI pertama dan paling umum digunakan. Obat ini diperkenalkan oleh Wyeth pada tahun 1994. Efek penyerapan kembali venlafaksin bergantung pada dosis. Pada dosis rendah (<150 mg/hari), obat ini hanya bekerja pada transmisi serotonergik. Pada dosis sedang (>150 mg/hari), obat ini bekerja pada sistem serotonergik dan noradrenergik. Sedangkan pada dosis tinggi (>300 mg/hari), obat ini juga memengaruhi neurotransmisi dopaminergik.[24] Pada dosis kecil, venlafaksin juga terbukti efektif dalam mengobati gejala vasomotor (rasa panas dan keringat malam) pada masa menopause.[23] |
Mekanisme kerja
[sunting | sunting sumber]Monoamina dihubungkan dengan patofisiologi depresi. Gejala dapat terjadi karena konsentrasi neurotransmiter, seperti norepinefrin dan serotonin, tidak mencukupi, yang menyebabkan perubahan hilir.[13][25] Obat untuk depresi memengaruhi transmisi serotonin, norepinefrin, dan dopamin.[13] Antidepresan yang lebih lama dan kurang selektif seperti TCA dan MAOI menghambat penyerapan kembali atau metabolisme norepinefrin dan serotonin di otak, yang menghasilkan konsentrasi neurotransmiter yang lebih tinggi.[25] Antidepresan yang memiliki mekanisme kerja ganda menghambat penyerapan kembali serotonin dan norepinefrin, dan dalam beberapa kasus menghambat dengan efek yang lemah pada penyerapan kembali dopamin.[13] Antidepresan memengaruhi reseptor neuronal variabel seperti kolinergik muskarinik, adrenergik α1 dan α2, histaminergik H1, dan saluran natrium di otot jantung, yang menyebabkan penurunan konduksi jantung dan kardiotoksisitas yang khususnya terkait dengan TCA, dan pada tingkat yang lebih rendah dengan SSRI.[26] Selektivitas agen antidepresan didasarkan pada neurotransmiter yang dianggap memengaruhi gejala depresi.[27] Obat yang secara selektif memblokir penyerapan kembali serotonin dan norepinefrin secara efektif mengobati depresi dan ditoleransi lebih baik daripada TCA. TCA memiliki efek komprehensif pada berbagai reseptor neurotransmiter, yang menyebabkan kurangnya tolerabilitas dan peningkatan risiko toksisitas.[2]
Antidepresan trisiklik
[sunting | sunting sumber]
Antidepresan trisiklik (TCA) adalah obat pertama yang memiliki mekanisme kerja ganda. Mekanisme kerja antidepresan amina sekunder trisiklik hanya dipahami sebagian. TCA memiliki efek penghambatan ganda pada transporter penyerapan kembali norepinefrin dan transporter penyerapan kembali serotonin. Peningkatan konsentrasi norepinefrin dan serotonin diperoleh dengan menghambat kedua protein transporter ini. TCA memiliki afinitas yang jauh lebih besar terhadap protein penyerapan kembali norepinefrin daripada SSRI. Hal ini karena pembentukan metabolit amina sekunder TCA.[28][29]
Selain itu, TCA berinteraksi dengan reseptor adrenergik. Interaksi ini tampaknya penting untuk peningkatan ketersediaan norepinefrin di dalam atau di dekat celah sinaptik. Tindakan antidepresan trisiklik mirip imipramin memiliki adaptasi sekunder yang kompleks terhadap tindakan awal, dan berkelanjutannya sebagai penghambat transportasi norepinefrin, dan blokade variabel transportasi serotonin.
Norepinefrin berinteraksi dengan subtipe reseptor adrenergik α dan β postsinaptik dan autoreseptor α2 presinaptik. Reseptor α2 mencakup autoreseptor presinaptik yang membatasi aktivitas neurofisiologis neuron noradrenergik di sistem saraf pusat. Pembentukan norepinefrin dikurangi oleh autoreseptor melalui enzim tirosin hidroksilase yang membatasi laju, efek yang dimediasi oleh penurunan fosforilasi-aktivasi enzim yang dimediasi oleh siklik AMP.[29] Reseptor α2 juga menyebabkan penurunan ekspresi siklik AMP intraseluler yang mengakibatkan relaksasi otot polos atau penurunan sekresi.[30]
TCA mengaktifkan mekanisme umpan balik negatif melalui efeknya pada reseptor presinaptik. Satu kemungkinan penjelasan untuk efek pada penurunan pelepasan neurotransmitter adalah bahwa saat reseptor aktif terjadi penghambatan pelepasan neurotransmiter (termasuk penekanan arus Ca2+ yang bergantung pada tegangan, dan aktivasi arus K+ yang dioperasikan oleh reseptor yang digabungkan dengan protein G). Paparan berulang terhadap agen dengan jenis mekanisme ini menyebabkan penghambatan pelepasan neurotransmiter, tetapi pemberian TCA berulang akhirnya menyebabkan penurunan respons oleh reseptor α2. Desensitisasi respons ini mungkin disebabkan oleh peningkatan paparan norepinefrin endogen, atau dari okupasi mekanisme transpor norepinefrin yang berkepanjangan (melalui efek alosterik). Adaptasi ini memungkinkan sintesis dan sekresi norepinefrin presinaptik untuk kembali ke (atau bahkan melebihi) kadar norepinefrin normal di celah sinaptik. Secara keseluruhan, penghambatan penyerapan kembali norepinefrin yang diinduksi oleh TCA menyebabkan penurunan laju penembakan neuron (dimediasi melalui autoreseptor α2), aktivitas metabolik, dan pelepasan neurotransmiter.[29]
TCA tidak secara langsung menghalangi transportasi dopamin, tetapi mungkin memfasilitasi efek dopaminergik secara tidak langsung dengan menghambat transportasi dopamin ke terminal noradrenergik korteks otak besar.[29] Karena mempengaruhi banyak reseptor yang berbeda, TCA memiliki efek samping, tolerabilitas yang buruk, dan peningkatan risiko toksisitas.[2]
Penghambat penyerapan kembali serotonin selektif
[sunting | sunting sumber]Penghambat penyerapan kembali serotonin selektif (SSRI) secara selektif menghambat penyerapan kembali serotonin dan merupakan kelompok antidepresan yang banyak digunakan.[31] Dengan peningkatan selektivitas reseptor dibandingkan dengan TCA, efek yang tidak diinginkan seperti tolerabilitas yang buruk dapat dihindari.[29] Serotonin disintesis dari asam amino yang disebut L-triptofan. Sistem transpor aktif mengatur penyerapan triptofan melintasi sawar darah otak. Jalur serotonergik diklasifikasikan menjadi dua jalur utama di otak: proyeksi menaik dari raphe medial dan dorsal dan proyeksi menurun dari raphe kaudal ke sumsum tulang belakang.
Penghambat penyerapan kembali norepinefrin selektif
[sunting | sunting sumber]Neuron noradrenergik terletak di dua wilayah utama di otak. Wilayah ini adalah locus coeruleus dan tegmental lateral. Dengan pemberian SNRI, aktivitas neuronal di daerah locus coeruleus diinduksi karena peningkatan konsentrasi norepinefrin di celah sinaptik. Hal ini mengakibatkan aktivasi reseptor adrenergik α2,[25] seperti yang dibahas sebelumnya.
Pengujian telah menunjukkan bahwa SNRI memiliki kecenderungan yang tidak signifikan terhadap reseptor mACh, adrenergik α1 dan α2, atau H1.[27]
Penghambat penyerapan kembali serotonin dan norepinefrin ganda
[sunting | sunting sumber]Agen dengan penghambatan penyerapan kembali serotonin dan norepinefrin ganda terkadang disebut penghambat penyerapan kembali serotonin dan norepinefrin non-trisiklik. Studi klinis menunjukkan bahwa senyawa yang meningkatkan konsentrasi norepinefrin dan serotonin di celah sinaptik lebih berhasil daripada agen kerja tunggal dalam pengobatan depresi, tetapi data tersebut tidak meyakinkan apakah SNRI merupakan pilihan pengobatan yang lebih efektif daripada SSRI untuk depresi.[32][33][34]
SNRI non-trisiklik memiliki beberapa perbedaan penting yang didasarkan pada farmakokinetika, metabolisme menjadi metabolit aktif, penghambatan isoform CYP, efek interaksi obat-obat, dan waktu paruh SNRI non-trisiklik.[28][35]
Kombinasi mekanisme aksi dalam satu agen aktif merupakan perkembangan penting dalam psikofarmakologi.[35]
Hubungan aktivitas struktur
[sunting | sunting sumber]Perancah ariloksipropanamina
[sunting | sunting sumber]Beberapa penghambat penyerapan kembali mengandung perancah ariloksipropanamina. Motif struktural ini berpotensi untuk mengikat afinitas tinggi pada transpor amina biogenik.[35] Obat yang mengandung perancah ariloksipropanamina memiliki profil selektivitas untuk transporter norepinefrin dan serotonin yang bergantung pada pola substitusi cincin ariloksi. NRI selektif mengandung substituen pada posisi 2' dari cincin ariloksi, tetapi SSRI mengandung substituen pada posisi 4' dari cincin ariloksi. Atomoksetin, nisoksetin, dan reboksetin semuanya memiliki gugus substitusi pada posisi 2' dan merupakan NRI selektif, sementara senyawa yang memiliki gugus substitusi pada posisi 4' (seperti fluoksetin dan paroksetin) merupakan SSRI. Duloksetin mengandung gugus fenil yang menyatu pada posisi 2' dan 3', oleh karena itu ia memiliki efek penghambatan penyerapan kembali norepinefrin dan serotonin selektif ganda dan memiliki potensi yang sama untuk kedua transporter.[36] Sifat substituen aromatik juga memiliki pengaruh yang signifikan terhadap aktivitas dan selektivitas senyawa sebagai penghambat transporter serotonin atau norepinefrin.[35]

Perancah sikloalkanol metilamin
[sunting | sunting sumber]Venlafaksin dan desvenlafaksin mengandung perancah sikloalkanol metilamin. Peningkatan sifat penarik elektron dari cincin aromatik memberikan efek penghambatan yang lebih kuat terhadap penyerapan norepinefrin dan meningkatkan selektivitas norepinefrin terhadap transporter serotonin. Efek substituen kloro, metoksi, dan trifluorometil dalam cincin aromatik perancah sikloalkanol metilamin diuji. Hasil penelitian menunjukkan bahwa analog m-trifluorometil penarik elektron terkuat menunjukkan efek penghambatan norepinefrin yang paling kuat dan selektivitas tertinggi terhadap penyerapan serotonin.[36] WY-46824, turunan yang mengandung piperazina, telah menunjukkan penghambatan penyerapan kembali norepinefrin dan dopamin. Sintesis dan pengujian lebih lanjut mengidentifikasi WAY-256805, penghambat penyerapan kembali norepinefrin kuat yang menunjukkan selektivitas yang sangat baik dan berkhasiat pada model hewan yang mengalami depresi, nyeri, dan disfungsi termoregulasi.[37]

Milnacipran
[sunting | sunting sumber]
Milnacipran secara struktural berbeda dari SNRI lainnya.[28] Hubungan struktur aktivitas turunan milnacipran pada tingkat transporter masih belum jelas dan didasarkan pada efikasi in vivo yang dilaporkan pada tahun 1987. N-metilasi milnacipran pada kelompok substituen R4 dan R5 mengurangi aktivitas norepinefrin dan serotonin. Penelitian pada berbagai amida sekunder pada kelompok substitusi R6 dan R7 menunjukkan bahwa elektron π memainkan peran penting dalam interaksi antara transporter dan ligan. Kelompok fenil pada substituen R6 menunjukkan efek pada transporter norepinefrin. Kelompok substituen pada R6 dan R7 dengan ikatan rangkap alilik menunjukkan peningkatan efek yang signifikan pada transporter norepinefrin dan serotonin.[38] Studi menunjukkan bahwa dengan memasukkan kelompok 2-metil pada substituen R3, potensi pada transporter norepinefrin dan serotonin hampir hilang. Kelompok metil dalam kelompok substituen R1 dan R2 juga menghilangkan potensi pada transporter norepinefrin dan serotonin. Para peneliti menemukan bahwa mengganti salah satu kelompok etil milnacipran dengan gugus alil meningkatkan potensi norepinefrin.[39] Farmakofor turunan milnacipran masih belum jelas.[38]
Konformasi milnacipran merupakan bagian penting dari farmakofornya. Mengubah stereokimianya memengaruhi konsentrasi norepinefrin dan serotonin. Milnacipran dipasarkan sebagai campuran rasemat. Efek milnacipran berada pada isomer (1S,2R) dan substitusi gugus fenil pada isomer (1S,2R) berdampak negatif pada konsentrasi norepinefrin. Milnacipran memiliki berat molekul rendah dan lipofilitas rendah. Karena sifat-sifat ini, milnacipran menunjukkan farmakokinetika yang hampir ideal pada manusia seperti bioavailabilitas tinggi, variabilitas antar subjek rendah, interaksi enzim hati terbatas, distribusi jaringan sedang dan waktu paruh eliminasi cukup panjang. Kurangnya interaksi obat-obat melalui enzim sitokrom P450 pada milnacipran dianggap sebagai fitur yang menarik karena banyak obat sistem saraf pusat sangat lipofilik dan sebagian besar dieliminasi oleh enzim hati.[39]
Pengembangan hubungan struktur aktivitas di masa mendatang
[sunting | sunting sumber]Penerapan perancah ariloksipropanamina telah menghasilkan sejumlah MAOI yang poten.[40] Sebelum pengembangan duloksetin, eksplorasi hubungan struktur aktivitas ariloksipropanamina menghasilkan identifikasi fluoksetin dan atomoksetin. Motif yang sama dapat ditemukan dalam reboksetin yang dibatasi dalam sistem cincin morfolin. Beberapa penelitian telah dilakukan di mana oksigen dalam reboksetin digantikan oleh belerang untuk menghasilkan ariltiometil morfolin. Beberapa turunan ariltiometil morfolin mempertahankan kadar penghambatan penyerapan kembali serotonin dan norepinefrin yang poten. Penghambatan reuptake serotonin dan norepinefrin ganda berada dalam enantiomer yang berbeda untuk perancah ariltiometil morfolin.[41] Calon obat yang mungkin dengan aktivitas penghambatan penyerapan kembali serotonin dan norepinefrin ganda juga telah diturunkan dari templat piperazina, 3-amino-pirolidina, dan benzilamina.[42]
Uji klinis
[sunting | sunting sumber]Depresi
[sunting | sunting sumber]Beberapa penelitian telah menunjukkan bahwa obat antidepresan yang menggabungkan aktivitas serotonergik dan noradrenergik umumnya lebih efektif daripada SSRI, yang bekerja pada penyerapan kembali serotonin dengan sendirinya. Obat antidepresan serotonergik-noradrenergik mungkin memiliki keunggulan efikasi yang sederhana dibandingkan dengan SSRI dalam mengobati gangguan depresi mayor (MDD),[43] tetapi sedikit kurang dapat ditoleransi dengan baik.[44] Penelitian lebih lanjut diperlukan untuk memeriksa kemungkinan perbedaan efikasi pada subpopulasi MDD tertentu atau untuk gejala MDD tertentu, antara kelas obat antidepresan ini.
Analgesik
[sunting | sunting sumber]Data dari uji klinis telah menunjukkan bahwa SNRI mungkin memiliki sifat meredakan nyeri. Meskipun persepsi dan transmisi rangsangan nyeri di sistem saraf pusat belum sepenuhnya dijelaskan, data yang luas mendukung peran serotonin dan norepinefrin dalam modulasi nyeri. Temuan dari uji klinis pada manusia telah menunjukkan bahwa antidepresan ini dapat membantu mengurangi nyeri dan gangguan fungsional pada kondisi nyeri sentral dan neuropatik. Properti SNRI ini dapat digunakan untuk mengurangi dosis obat pereda nyeri lain dan menurunkan frekuensi masalah keamanan, keterbatasan efikasi, dan tolerabilitas.[45] Data penelitian klinis telah menunjukkan pada pasien dengan GAD bahwa duloksetin secara signifikan lebih efektif daripada plasebo dalam mengurangi gejala nyeri terkait GAD, setelah pengobatan jangka pendek dan jangka panjang. Namun, temuan menunjukkan bahwa gejala nyeri fisik tersebut muncul kembali dalam situasi kambuh, yang menunjukkan perlunya pengobatan berkelanjutan pada pasien dengan GAD dan gejala fisik nyeri yang terjadi bersamaan.[46]
Indikasi
[sunting | sunting sumber]SNRI telah diuji untuk pengobatan kondisi berikut:
- Gangguan depresi mayor (MDD)
- Gangguan stres pascatrauma (PTSD)
- Gangguan kecemasan menyeluruh (GAD)
- Gangguan kecemasan sosial (SAD)
- Gangguan obsesif kompulsif[47]
- Gangguan panik
- Nyeri neuropatik
- Fibromialgia
- Nyeri muskuloskeletal kronis
Farmakologi
[sunting | sunting sumber]Rute pemberian
[sunting | sunting sumber]
SNRI diberikan secara oral, biasanya dalam bentuk kapsul atau tablet. Dianjurkan untuk mengonsumsi SNRI di pagi hari bersama sarapan, yang tidak memengaruhi kadar obat, tetapi dapat membantu mengatasi efek samping tertentu.[48] Norepinefrin memiliki efek aktivasi dalam tubuh dan karenanya dapat menyebabkan insomnia pada beberapa pasien jika dikonsumsi sebelum tidur.[49] SNRI juga dapat menyebabkan mual, yang biasanya ringan dan hilang dalam beberapa minggu setelah pengobatan, tetapi mengonsumsi obat bersama makanan dapat membantu meredakannya.[50]
Cara kerja
[sunting | sunting sumber]Kondisi yang paling banyak diindikasikan untuk SNRI yakni gangguan depresi mayor, dianggap terutama disebabkan oleh penurunan kadar serotonin dan norepinefrin di celah sinaptik, yang menyebabkan sinyal tidak menentu. Namun teori tersebut telah dibantah.[51] Berdasarkan hipotesis monoamina depresi, yang menyatakan bahwa penurunan konsentrasi neurotransmiter monoamina menyebabkan gejala depresi, hubungan berikut ditentukan: "Norepinefrin mungkin terkait dengan kewaspadaan dan energi serta kecemasan, perhatian, dan minat dalam hidup; [kekurangan] serotonin dengan kecemasan, obsesi, dan kompulsi; dan dopamin dengan perhatian, motivasi, kesenangan, dan penghargaan, serta minat dalam hidup."[52] SNRI bekerja dengan menghambat penyerapan kembali neurotransmiter serotonin dan norepinefrin. Hal ini menghasilkan peningkatan konsentrasi ekstraseluler serotonin dan norepinefrin, akibatnya terjadi peningkatan neurotransmisi. Sebagian besar SNRI termasuk venlafaksin, desvenlafaksin, dan duloksetin, beberapa kali lipat lebih selektif untuk serotonin daripada norepinefrin, sementara milnacipran tiga kali lebih selektif untuk norepinefrin daripada serotonin. Peningkatan kadar norepinefrin dianggap perlu agar antidepresan efektif melawan nyeri neuropatik, suatu sifat yang dimiliki oleh antidepresan trisiklik (TCA) yang lebih lama, tetapi tidak dengan SSRI.[53]
Penelitian terkini telah menunjukkan bahwa depresi dapat dikaitkan dengan peningkatan respons inflamasi,[54] sehingga upaya untuk menemukan mekanisme tambahan untuk SNRI telah dilakukan. Penelitian telah menunjukkan bahwa SNRI dan SSRI memiliki tindakan antiinflamasi yang signifikan pada mikroglia.[55]
Farmakodinamik
[sunting | sunting sumber]Sebagian besar SNRI berfungsi bersama metabolit primer dan metabolit sekunder untuk menghambat penyerapan kembali serotonin, norepinefrin, dan sejumlah kecil dopamin. Misalnya, venlafaksin bekerja bersama metabolit primernya O-desmetilvenlafaksin untuk menghambat penyerapan kembali serotonin dan norepinefrin di otak. Bukti juga menunjukkan bahwa dopamin dan norepinefrin berperilaku dalam cara kotransportasi, karena inaktivasi dopamin oleh penyerapan kembali norepinefrin di korteks frontal, area otak yang sebagian besar kekurangan transporter dopamin. Efek SNRI ini menghasilkan peningkatan neurotransmisi dopamin, selain peningkatan aktivitas serotonin dan norepinefrin.[56] Lebih jauh, karena SNRI sangat selektif, SNRI tidak memiliki efek terukur pada reseptor lain yang tidak diinginkan, berbeda dengan penghambatan oksidase monoamina.[57] Pengujian farmasi telah menentukan bahwa penggunaan SNRI atau SSRI dapat menghasilkan tindakan antiinflamasi yang signifikan pada mikroglia.[55][19][58][59][14][60]
Profil aktivitas
[sunting | sunting sumber]| Obat | SERT | NET | ~Rasio (5-HT : NE) | ||
|---|---|---|---|---|---|
| Ki | IC50 | Ki | IC50 | ||
| Venlafaksin | 7,8 | 145 | 1.920 | 1420 | 9,8:1 |
| Desvenlafaksin | 40,2 | 47,3 | 558,4 | 531,3 | 11,2:1 |
| Duloksetin | 0,07 | 3,7 | 1,17 | 20 | 5,4:1 |
| Atomoksetin | 87[62] | 5,4[62] | 0,06:1 (= 1:16) | ||
| Milnacipran | 8,44 | 151 | 22 | 68 | 0,45:1 (= 1:2,2) |
| Levomilnacipran | 11,2 | 19,0 | 92,2 | 10,5 | 0,55:1 (= 1:1,8) |
| Semua nilai Ki dan IC50 adalah nM. Rasio 5-HT/NE didasarkan pada nilai based on IC50 untuk SERT dan NET.[61] | |||||
Farmakokinetik
[sunting | sunting sumber]Waktu paruh venlafaksin adalah sekitar 5 jam, dan dengan dosis sekali sehari, konsentrasi keadaan tunak dicapai setelah sekitar 3 hari, meskipun metabolit aktifnya yakni desvenlafaksin bertahan lebih lama.[59] Waktu paruh desvenlafaksin adalah sekitar 11 jam, dan konsentrasi keadaan tunak dicapai setelah 4 hingga 5 hari.[58] Waktu paruh duloksetin adalah sekitar 12 jam (kisaran: 8–17 jam), dan keadaan tunak dicapai setelah sekitar 3 hari.[14] Milnacipran memiliki waktu paruh sekitar 6 hingga 8 jam, dan kadar keadaan tunak dicapai dalam 36 hingga 48 jam.[60]
Kontraindikasi
[sunting | sunting sumber]SNRI dikontraindikasikan pada pasien yang mengonsumsi MAOI dalam dua minggu terakhir karena peningkatan risiko sindrom serotonin, yang dapat mengancam jiwa. Obat dan zat lain yang harus dihindari karena peningkatan risiko sindrom serotonin saat dikombinasikan dengan SNRI meliputi: antidepresan lain, antikonvulsan, analgesik, agen antiemetik, obat antimigrain, metilena biru, linezolid, Litium, St. John's wort, ekstasi, dan LSD.[64] Tanda dan gejala sindrom serotonin meliputi: hipertermia, kekakuan, mioklonus, ketidakstabilan otonom dengan tanda-tanda vital yang berfluktuasi, dan perubahan status mental yang meliputi agitasi ekstrem yang berkembang menjadi delirium dan koma.[14]
Karena efek peningkatan kadar norepinefrin, dan oleh karena itu, aktivitas noradrenergik yang lebih tinggi, hipertensi yang sudah ada sebelumnya harus dikontrol sebelum pengobatan dengan SNRI dan tekanan darah dipantau secara berkala selama pengobatan.[65] Duloksetin juga dikaitkan dengan kasus gagal hati dan tidak boleh diresepkan kepada pasien dengan penggunaan alkohol kronis atau penyakit hati. Studi telah menemukan bahwa duloksetin dapat meningkatkan tes fungsi hati tiga kali lipat di atas batas normal atasnya.[66] Pasien dengan penyakit jantung koroner harus berhati-hati dalam penggunaan SNRI.[67] Lebih jauh lagi, karena beberapa tindakan SNRI terhadap obesitas, pasien dengan gangguan makan utama seperti anoreksia nervosa atau bulimia nervosa tidak boleh diresepkan SNRI.[19] Duloksetin dan milnacipran juga dikontraindikasikan pada pasien dengan glaukoma sudut sempit yang tidak terkontrol, karena telah terbukti meningkatkan kejadian midriasis.[14][60]
Efek samping
[sunting | sunting sumber]Karena SNRI dan SSRI bekerja dengan cara yang sama untuk meningkatkan kadar serotonin, keduanya memiliki banyak efek samping meski dengan tingkat yang berbeda-beda. Efek samping yang paling umum meliputi mual/muntah, berkeringat, kehilangan nafsu makan, pusing, sakit kepala, peningkatan pikiran untuk bunuh diri, dan disfungsi seksual.[68] Peningkatan kadar norepinefrin terkadang dapat menyebabkan kecemasan, denyut nadi sedikit meningkat, dan tekanan darah tinggi. Namun antidepresan selektif norepinefrin seperti reboksetin dan desipramin telah berhasil mengobati gangguan kecemasan.[69] Orang yang berisiko hipertensi dan penyakit jantung harus memantau tekanan darah mereka.[19][58][59][14][60]
Disfungsi Seksual
[sunting | sunting sumber]SNRI dan SSRI dapat menyebabkan beberapa jenis disfungsi seksual seperti disfungsi ereksi, penurunan libido, anhedonia seksual, dan anorgasmia.[14][59][70] Dua efek samping seksual yang umum adalah berkurangnya minat terhadap seks (libido) dan kesulitan mencapai klimaks (anorgasmia), yang biasanya agak lebih ringan dengan SNRI dibandingkan dengan SSRI.[71] Untuk mengelola disfungsi seksual, penelitian telah menunjukkan bahwa beralih ke atau menambah bupropion atau menambahkan penghambat PDE5 telah mengurangi gejala disfungsi seksual. Penelitian telah menunjukkan bahwa penghambat PDE5 seperti sildenafil (Viagra), tadalafil (Cialis), vardenafil (Levitra), dan avanafil (Stendra) terkadang membantu mengurangi disfungsi seksual termasuk disfungsi ereksi, meski obat-obat tersebut telah terbukti lebih efektif pada pria daripada wanita.[72]
Sindrom Serotonin
[sunting | sunting sumber]Efek samping SNRI yang serius tetapi jarang terjadi adalah sindrom serotonin, yang disebabkan oleh kelebihan serotonin dalam tubuh. Sindrom serotonin dapat disebabkan oleh penggunaan beberapa obat serotonergik seperti SSRI atau SNRI. Obat lain yang berkontribusi terhadap sindrom serotonin meliputi MAOI, linezolid, tedizolid, metilena biru, prokarbazin, amfetamin, klomipramin, dan banyak lagi.[73] Gejala awal sindrom serotonin dapat meliputi mual, muntah, diare, berkeringat, agitasi, kebingungan, kekakuan otot, pupil melebar, hipertermia, kekakuan, dan bulu kuduk berdiri. Gejala yang lebih parah meliputi demam, sawan, detak jantung tidak teratur, delirium, dan koma.[74][75][14] Jika tanda atau gejala muncul, segera hentikan pengobatan dengan agen serotonergik.[74] Dianjurkan untuk mencuci 4 hingga 5 waktu paruh agen serotonergik sebelum menggunakan MAOI.[76]
Perdarahan
[sunting | sunting sumber]Beberapa penelitian menunjukkan adanya risiko perdarahan gastrointestinal bagian atas, terutama akibat dari venlafaksin, karena gangguan agregasi trombosit dan penipisan kadar serotonin trombosit.[77][78] Mirip dengan SSRI, SNRI dapat berinteraksi dengan antikoagulan seperti warfarin. Ada lebih banyak bukti bahwa SSRI memiliki risiko perdarahan yang lebih tinggi daripada SNRI.[77] Penelitian telah menyarankan kehati-hatian saat menggunakan SNRI atau SSRI dengan obat antiinflamasi nonsteroid (OAINS) dosis tinggi seperti ibuprofen atau naproksen karena peningkatan risiko perdarahan gastrointestinal bagian atas.[34]
Masalah penglihatan
[sunting | sunting sumber]
Sama seperti antidepresan lainnya, obat SNRI diketahui menyebabkan sindrom salju visual (VSS), yakni suatu kondisi yang ditandai dengan gangguan penglihatan, palinopsia (negatif setelah melihat gambar), rabun senja (penglihatan buruk di malam hari), dan fotofobia (tampilan cahaya atau warna yang lebih terang). Bukti menunjukkan bahwa 8,9% dari mereka yang mengonsumsi SNRI mengalami salju visual; 10,5% mengalami palinopsia; 15,3% mengalami fotofobia; dan 17,7% mengalami niktolopia sebagai akibat dari asupan resep SNRI. Amitriptilin dan citalopram juga dilaporkan memperburuk atau menyebabkan gejala VSS.[79]
Tindakan pencegahan
[sunting | sunting sumber]Memulai regimen SNRI
[sunting | sunting sumber]Karena perubahan ekstrem dalam aktivitas noradrenergik yang dihasilkan dari penghambatan penyerapan kembali norepinefrin dan serotonin, pasien yang baru memulai regimen SNRI biasanya diberikan dosis yang lebih rendah daripada dosis akhir yang diharapkan untuk memungkinkan tubuh menyesuaikan diri dengan efek obat. Saat pasien melanjutkan dengan dosis rendah tanpa efek samping, dosis ditingkatkan secara bertahap hingga pasien melihat perbaikan gejala tanpa efek samping yang merugikan.[80]
Sindrom penghentian
[sunting | sunting sumber]Seperti halnya SSRI, penghentian SNRI secara tiba-tiba biasanya menyebabkan putus obat, atau "sindrom penghentian", yang dapat mencakup keadaan cemas dan gejala lainnya. Oleh karena itu, disarankan bagi pengguna yang ingin menghentikan SNRI untuk secara perlahan mengurangi dosis harus di bawah pengawasan seorang profesional. Sindrom penghentian dilaporkan jauh lebih buruk pada venlafaksin jika dibandingkan dengan SNRI lainnya. Dengan demikian, karena tramadol berhubungan dengan venlafaksin, kondisi yang sama berlaku.[81] Hal ini kemungkinan besar disebabkan oleh waktu paruh venlafaksin yang relatif pendek, dan oleh karena itu pembersihannya cepat setelah penghentian. Dalam beberapa kasus, beralih dari venlafaksin ke fluoksetin, suatu SSRI kerja panjang, dan kemudian mengurangi fluoksetin, mungkin direkomendasikan untuk mengurangi gejala penghentian.[82][83] Tanda dan gejala putus obat dari penghentian SNRI secara tiba-tiba termasuk pusing, kecemasan, insomnia, mual, berkeringat, dan gejala seperti flu seperti kelesuan dan malaise.[83]
Overdosis
[sunting | sunting sumber]Penyebab
[sunting | sunting sumber]Overdosis SNRI dapat disebabkan oleh kombinasi obat atau jumlah obat itu sendiri yang berlebihan. Venlafaksin sedikit lebih beracun jika overdosis daripada duloksetin atau SSRI.[19][58][59][14][60][84]
Gejala
[sunting | sunting sumber]Gejala overdosis SNRI, baik itu interaksi obat campuran atau obat itu sendiri, bervariasi dalam intensitas dan kejadian berdasarkan jumlah obat yang diminum dan sensitivitas individu terhadap pengobatan SNRI. Gejala yang mungkin terjadi meliputi:[14]
- Mengantuk
- Koma
- Sindrom serotonin
- Sawan
- Pingsan
- Takikardia
- Hipotensi
- Hipertensi
- Hipertermia
- Muntah
Penanganan
[sunting | sunting sumber]Overdosis biasanya diobati secara simtomatik, terutama dalam kasus sindrom serotonin, yang memerlukan pengobatan dengan siproheptadin dan pengendalian suhu berdasarkan perkembangan toksisitas serotonin.[85] Pasien sering dipantau tanda-tanda vitalnya, dan saluran pernapasan dibersihkan untuk memastikan bahwa mereka menerima kadar oksigen yang cukup. Pilihan lain adalah menggunakan karbon aktif di saluran cerna untuk menyerap kelebihan neurotransmiter.[14]
Perbandingan dengan SSRI
[sunting | sunting sumber]Karena SNRI dikembangkan lebih baru daripada SSRI, jumlahnya relatif sedikit. Namun, SNRI termasuk antidepresan yang paling banyak digunakan saat ini. Pada tahun 2009, Cymbalta dan Effexor masing-masing adalah obat bermerek yang paling banyak diresepkan ke-11 dan ke-12 di Amerika Serikat. Ini berarti bahwa SNRI adalah antidepresan yang paling umum ke-2 dan ke-3, setelah Lexapro (escitalopram, suatu SSRI).[86] Dalam beberapa penelitian, SNRI menunjukkan efikasi antidepresan yang sedikit lebih tinggi daripada SSRI (tingkat respons 63,6% versus 59,3%).[43] Namun, dalam satu penelitian, escitalopram memiliki profil efikasi yang lebih unggul daripada venlafaksin.[87]
Populasi khusus
[sunting | sunting sumber]Kehamilan
[sunting | sunting sumber]Tidak ada antidepresan yang disetujui FDA selama kehamilan. Penggunaan antidepresan selama kehamilan dapat mengakibatkan kelainan pada janin yang memengaruhi perkembangan fungsional otak dan perilaku.[88] Penelitian telah menunjukkan korelasi antara wanita hamil yang diobati dengan SNRI dan risiko gangguan hipertensi,[89] preeklamsia,[90] keguguran,[91] sawan pada anak-anak,[92] dan banyak efek samping lainnya.
Pediatri
[sunting | sunting sumber]SSRI dan SNRI telah terbukti efektif dalam mengobati gangguan depresi mayor dan kecemasan pada populasi anak-anak.[93] Namun, perbedaan dalam metabolisme, fungsi ginjal, serta persentase total air tubuh dan lemak tubuh dapat memengaruhi farmakokinetik obat-obatan pada remaja dibandingkan dengan orang dewasa.[94] Selain itu, ada risiko peningkatan keinginan bunuh diri pada populasi anak-anak untuk pengobatan gangguan depresi mayor, terutama dengan venlafaksin.[93] Fluoksetin dan Escitalopram adalah satu-satunya antidepresan yang disetujui untuk gangguan depresi mayor pada anak/remaja.[94] Tinjauan pustaka oleh Castagna, dkk. dari tahun 2023 menunjukkan indikasi kemanjuran dalam mengobati gangguan kecemasan umum pada anak. Saat ini, Duloksetin, sebuah SNRI, adalah satu-satunya obat yang disetujui FDA untuk GAD pada anak, meskipun faktanya SSRI biasanya merupakan pengobatan lini pertama.[94][95] Disarankan agar obat-obatan ini dikombinasikan dengan psikoterapi untuk memaksimalkan efektivitas.[96][94]
Geriatri
[sunting | sunting sumber]Sebagian besar antidepresan, termasuk SNRI, aman dan efektif untuk populasi geriatri. Populasi geriatri berisiko lebih besar mengalami efek samping yang berkaitan dengan interaksi obat karena mereka lebih mungkin mengalami polifarmasi.[97] Keputusan sering kali didasarkan pada kondisi komorbiditas, interaksi obat, dan toleransi pasien. Karena perbedaan komposisi tubuh dan metabolisme, dosis awal sering kali setengah dari dosis yang direkomendasikan untuk orang dewasa yang lebih muda.[98] Penelitian menunjukkan bahwa faktor-faktor ini juga meningkatkan risiko efek samping pada populasi geriatri ketika diobati dengan SNRI, tetapi tidak dengan SSRI.[99][100]
Penelitian
[sunting | sunting sumber]Tinjauan sistematis yang meneliti kemanjuran antidepresan untuk menghilangkan rasa sakit menyimpulkan bahwa hanya 11 dari 42 perbandingan yang menunjukkan bukti kemanjuran. Tujuh dari sebelas perbandingan termasuk dalam golongan obat SNRI.[101]
Referensi
[sunting | sunting sumber]- ^ Cleveland Clinic medical professional (2023-03-05). "SNRIs". Cleveland Clinic. Diakses tanggal 2024-01-09.
- ^ a b c Stahl SM, Grady MM, Moret C, Briley M (September 2005). "SNRIs: their pharmacology, clinical efficacy, and tolerability in comparison with other classes of antidepressants". CNS Spectrums. 10 (9): 732–747. doi:10.1017/S1092852900019726. PMID 16142213.
- ^ Cashman JR, Ghirmai S (October 2009). "Inhibition of serotonin and norepinephrine reuptake and inhibition of phosphodiesterase by multi-target inhibitors as potential agents for depression". Bioorganic & Medicinal Chemistry. 17 (19): 6890–6897. doi:10.1016/j.bmc.2009.08.025. PMID 19740668.
- ^ Wright ME, Rizzolo D (March 2017). "An update on the pharmacologic management and treatment of neuropathic pain". JAAPA. 30 (3): 13–17. doi:10.1097/01.JAA.0000512228.23432.f7. PMID 28151738.
- ^ Spina E, Santoro V, D'Arrigo C (July 2008). "Clinically relevant pharmacokinetic drug interactions with second-generation antidepressants: an update". Clinical Therapeutics. 30 (7): 1206–1227. doi:10.1016/S0149-2918(08)80047-1. PMID 18691982.
- ^ a b Lieberman JA (2003). "History of the Use of Antidepressants in Primary Care" (PDF). Primary Care Companion J Clin Psychiatry. 5 (S7): 6–10. Diarsipkan dari versi asli (PDF) tanggal 2014-06-11. Diakses tanggal 2014-03-05.
- ^ a b Gutierrez MA, Stimmel GL, Aiso JY (August 2003). "Venlafaxine: a 2003 update". Clinical Therapeutics. 25 (8): 2138–2154. doi:10.1016/s0149-2918(03)80210-2. PMID 14512125.
- ^ Ruelas EG, Diaz-Martinez A, Ruiz RM, Study TV, Group C (1997). "An open assessment of the acceptability, efficacy, and tolerance of venlafaxine in usual care settings". Current Therapeutic Research. 58 (9): 609–630. doi:10.1016/S0011-393X(97)80088-4.
- ^ Hillhouse TM, Porter JH (February 2015). "A brief history of the development of antidepressant drugs: from monoamines to glutamate". Experimental and Clinical Psychopharmacology. 23 (1): 1–21. doi:10.1037/a0038550. PMC 4428540
 . PMID 25643025.
. PMID 25643025.
- ^ a b Deecher DC, Beyer CE, Johnston G, Bray J, Shah S, Abou-Gharbia M, Andree TH (August 2006). "Desvenlafaxine succinate: A new serotonin and norepinephrine reuptake inhibitor". The Journal of Pharmacology and Experimental Therapeutics. 318 (2): 657–665. doi:10.1124/jpet.106.103382. PMID 16675639.
- ^ a b Perry R, Cassagnol M (June 2009). "Desvenlafaxine: a new serotonin-norepinephrine reuptake inhibitor for the treatment of adults with major depressive disorder". Clinical Therapeutics. 31 (1): 1374–1404. doi:10.1016/j.clinthera.2009.07.012. PMID 19698900.
- ^ Iyengar S, Webster AA, Hemrick-Luecke SK, Xu JY, Simmons RM (November 2004). "Efficacy of duloxetine, a potent and balanced serotonin-norepinephrine reuptake inhibitor in persistent pain models in rats". The Journal of Pharmacology and Experimental Therapeutics. 311 (2): 576–584. doi:10.1124/jpet.104.070656. PMID 15254142.
- ^ a b c d Hunziker ME, Suehs BT, Bettinger TL, Crismon ML (August 2005). "Duloxetine hydrochloride: a new dual-acting medication for the treatment of major depressive disorder". Clinical Therapeutics. 27 (8): 1126–1143. doi:10.1016/j.clinthera.2005.08.010. PMID 16199241.
- ^ a b c d e f g h i j k l "Cymbalta- duloxetine hydrochloride capsule, delayed release". DailyMed. 20 September 2021. Diakses tanggal 12 February 2023.
- ^ "Yentreve (duloxetine hydrochloride) Hard Gastro-Resistant Capsules. Summary of Product Characteristics" (PDF). European Medicines Agency. Diarsipkan dari versi asli (PDF) tanggal 26 June 2016. Diakses tanggal 29 August 2016.
- ^ "Nefazodone hydrochloride tablet". DailyMed. 16 November 2021. Diakses tanggal 12 February 2023.
- ^ a b Frampton JE, Plosker GL (2007). "Duloxetine: a review of its use in the treatment of major depressive disorder". CNS Drugs. 21 (7): 581–609. doi:10.2165/00023210-200721070-00004. PMID 17579500.
- ^ a b Morishita S, Arita S (February 2003). "The clinical use of milnacipran for depression". European Psychiatry. 18 (1): 34–35. doi:10.1016/S0924-9338(02)00003-2. PMID 12648895.
- ^ a b c d e "Meridia (sibutramine hydrochloride monohydrate) Capsules C-IV. Full Prescribing Information (archived label)". Abbott Laboratories, North Chicago, IL 60064, USA. Diakses tanggal 2 September 2016.
- ^ Luque CA, Rey JA (April 2002). "The discovery and status of sibutramine as an anti-obesity drug". European Journal of Pharmacology. 440 (2–3): 119–128. doi:10.1016/S0014-2999(02)01423-1. PMID 12007530.
- ^ Rockoff JD, Dooren JC (October 8, 2010). "Abbott Pulls Diet Drug Meridia Off US Shelves". The Wall Street Journal. Diarsipkan dari versi asli tanggal 11 October 2010. Diakses tanggal 8 October 2010.
- ^ Keating GM (2006). "Tramadol sustained-release capsules". Drugs. 66 (2): 223–230. doi:10.2165/00003495-200666020-00006. PMID 16451094.
- ^ a b Joffe H, Guthrie KA, LaCroix AZ, Reed SD, Ensrud KE, Manson JE, Newton KM, Freeman EW, Anderson GL, Larson JC, Hunt J, Shifren J, Rexrode KM, Caan B, Sternfeld B, Carpenter JS, Cohen L (July 2014). "Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial". JAMA Internal Medicine. 174 (7): 1058–1066. doi:10.1001/jamainternmed.2014.1891. PMC 4179877
 . PMID 24861828.
. PMID 24861828.
- ^ Redrobe JP, Bourin M, Colombel MC, Baker GB (July 1998). "Dose-dependent noradrenergic and serotonergic properties of venlafaxine in animal models indicative of antidepressant activity". Psychopharmacology. 138 (1): 1–8. doi:10.1007/s002130050638. PMID 9694520.
- ^ a b c Grandoso L, Pineda J, Ugedo L (May 2004). "Comparative study of the effects of desipramine and reboxetine on locus coeruleus neurons in rat brain slices". Neuropharmacology. 46 (6): 815–823. doi:10.1016/j.neuropharm.2003.11.033. PMID 15033341.
- ^ Pacher P, Kecskemeti V (2004). "Cardiovascular side effects of new antidepressants and antipsychotics: new drugs, old concerns?". Current Pharmaceutical Design. 10 (20): 2463–2475. doi:10.2174/1381612043383872. PMC 2493295
 . PMID 15320756.
. PMID 15320756.
- ^ a b Brunello N, Mendlewicz J, Kasper S, Leonard B, Montgomery S, Nelson J, Paykel E, Versiani M, Racagni G (October 2002). "The role of noradrenaline and selective noradrenaline reuptake inhibition in depression". European Neuropsychopharmacology. 12 (5): 461–475. doi:10.1016/s0924-977x(02)00057-3. PMID 12208564.
- ^ a b c Lemke TL, Williams DA, Roche VF, Zito SW (2008). Foye's principles of medicinal chemistry (edisi ke-6th). USA: Lippincott Williams & Wilkins. hlm. 547–67; 581–582.
- ^ a b c d e Brunton LL, Lazo JS, Parker KL, ed. (2006). Goodman & Gilman's: The Pharmacological Basis of Therapeutics (edisi ke-11). New York: McGraw-Hill.
- ^ Silverthorn DU, ed. (2007). Human Physiology (edisi ke-4). San Francisco: Pearson. hlm. 383–384.
- ^ Nutt DJ, Forshall S, Bell C, Rich A, Sandford J, Nash J, Argyropoulos S (July 1999). "Mechanisms of action of selective serotonin reuptake inhibitors in the treatment of psychiatric disorders". European Neuropsychopharmacology. 9 (Suppl 3): S81–S86. doi:10.1016/S0924-977X(99)00030-9. PMID 10523062.
- ^ Santarsieri D, Schwartz TL (2015). "Antidepressant efficacy and side-effect burden: a quick guide for clinicians". Drugs in Context. 4: 212290. doi:10.7573/dic.212290. PMC 4630974
 . PMID 26576188.
. PMID 26576188.
- ^ Clevenger SS, Malhotra D, Dang J, Vanle B, IsHak WW (January 2018). "The role of selective serotonin reuptake inhibitors in preventing relapse of major depressive disorder". Therapeutic Advances in Psychopharmacology. 8 (1): 49–58. doi:10.1177/2045125317737264. PMC 5761909
 . PMID 29344343.
. PMID 29344343.
- ^ a b Zeind C, Carvalho MG (2018). Applied Therapeutics: The Clinical Use of Drugs, 11e. Wolters Kluwer. hlm. 1813–1833. ISBN 9781496318299.
- ^ a b c d Boot J, Cases M, Clark BP, Findlay J, Gallagher PT, Hayhurst L, Man T, Montalbetti C, Rathmell RE, Rudyk H, Walter MW, Whatton M, Wood V (February 2005). "Discovery and structure-activity relationships of novel selective norepinephrine and dual serotonin/norepinephrine reuptake inhibitors". Bioorganic & Medicinal Chemistry Letters. 15 (3): 699–703. doi:10.1016/j.bmcl.2004.11.025. PMID 15664840.
- ^ a b Mahaney PE, Vu AT, McComas CC, Zhang P, Nogle LM, Watts WL, Sarkahian A, Leventhal L, Sullivan NR, Uveges AJ, Trybulski EJ (December 2006). "Synthesis and activity of a new class of dual acting norepinephrine and serotonin reuptake inhibitors: 3-(1H-indol-1-yl)-3-arylpropan-1-amines". Bioorganic & Medicinal Chemistry. 14 (24): 8455–8466. doi:10.1016/j.bmc.2006.08.039. PMID 16973367.
- ^ Mahaney PE, Gavrin LK, Trybulski EJ, Stack GP, Vu TA, Cohn ST, Ye F, Belardi JK, Santilli AA, Sabatucci JP, Leiter J, Johnston GH, Bray JA, Burroughs KD, Cosmi SA, Leventhal L, Koury EJ, Zhang Y, Mugford CA, Ho DM, Rosenzweig-Lipson SJ, Platt B, Smith VA, Deecher DC (July 2008). "Structure-activity relationships of the cycloalkanol ethylamine scaffold: discovery of selective norepinephrine reuptake inhibitors". Journal of Medicinal Chemistry. 51 (13): 4038–4049. doi:10.1021/jm8002262. PMID 18557608.
- ^ a b Chen C, Dyck B, Fleck BA, Foster AC, Grey J, Jovic F, Mesleh M, Phan K, Tamiya J, Vickers T, Zhang M (February 2008). "Studies on the SAR and pharmacophore of milnacipran derivatives as monoamine transporter inhibitors". Bioorganic & Medicinal Chemistry Letters. 18 (4): 1346–1349. doi:10.1016/j.bmcl.2008.01.011. PMID 18207394.
- ^ a b Tamiya J, Dyck B, Zhang M, Phan K, Fleck BA, Aparicio A, Jovic F, Tran JA, Vickers T, Grey J, Foster AC, Chen C (June 2008). "Identification of 1S,2R-milnacipran analogs as potent norepinephrine and serotonin transporter inhibitors". Bioorganic & Medicinal Chemistry Letters. 18 (11): 3328–3332. doi:10.1016/j.bmcl.2008.04.025. PMID 18445525.
- ^ Vu AT, Cohn ST, Terefenko EA, Moore WJ, Zhang P, Mahaney PE, Trybulski EJ, Goljer I, Dooley R, Bray JA, Johnston GH, Leiter J, Deecher DC (May 2009). "3-(Arylamino)-3-phenylpropan-2-olamines as a new series of dual norepinephrine and serotonin reuptake inhibitors". Bioorganic & Medicinal Chemistry Letters. 19 (9): 2464–2467. doi:10.1016/j.bmcl.2009.03.054. PMID 19329313.
- ^ Boot JR, Brace G, Delatour CL, Dezutter N, Fairhurst J, Findlay J, Gallagher PT, Hoes I, Mahadevan S, Mitchell SN, Rathmell RE, Richards SJ, Simmonds RG, Wallace L, Whatton MA (November 2004). "Benzothienyloxy phenylpropanamines, novel dual inhibitors of serotonin and norepinephrine reuptake". Bioorganic & Medicinal Chemistry Letters. 14 (21): 5395–5399. doi:10.1016/j.bmcl.2004.08.005. PMID 15454233.
- ^ Fish PV, Deur C, Gan X, Greene K, Hoople D, Mackenny M, Para KS, Reeves K, Ryckmans T, Stiff C, Stobie A, Wakenhut F, Whitlock GA (April 2008). "Design and synthesis of morpholine derivatives. SAR for dual serotonin & noradrenaline reuptake inhibition". Bioorganic & Medicinal Chemistry Letters. 18 (8): 2562–2566. doi:10.1016/j.bmcl.2008.03.050. PMID 18387300.
- ^ a b Papakostas GI, Thase ME, Fava M, Nelson JC, Shelton RC (December 2007). "Are antidepressant drugs that combine serotonergic and noradrenergic mechanisms of action more effective than the selective serotonin reuptake inhibitors in treating major depressive disorder? A meta-analysis of studies of newer agents". Biological Psychiatry. 62 (11): 1217–1227. doi:10.1016/j.biopsych.2007.03.027. PMID 17588546.
- ^ Nemeroff CB, Thase ME (2007). "A double-blind, placebo-controlled comparison of venlafaxine and fluoxetine treatment in depressed outpatients". Journal of Psychiatric Research. 41 (3–4): 351–359. doi:10.1016/j.jpsychires.2005.07.009. PMID 16165158.
- ^ Marks DM, Shah MJ, Patkar AA, Masand PS, Park GY, Pae CU (December 2009). "Serotonin-norepinephrine reuptake inhibitors for pain control: premise and promise". Current Neuropharmacology. 7 (4): 331–336. doi:10.2174/157015909790031201. PMC 2811866
 . PMID 20514212.
. PMID 20514212.
- ^ Beesdo K, Hartford J, Russell J, Spann M, Ball S, Wittchen HU (December 2009). "The short- and long-term effect of duloxetine on painful physical symptoms in patients with generalized anxiety disorder: results from three clinical trials". Journal of Anxiety Disorders. 23 (8): 1064–1071. doi:10.1016/j.janxdis.2009.07.008. PMID 19643572.
- ^ Sansone RA, Sansone LA (June 2011). "SNRIs pharmacological alternatives for the treatment of obsessive compulsive disorder?". Innovations in Clinical Neuroscience. 8 (6): 10–14. PMC 3140892
 . PMID 21779536.
. PMID 21779536.
- ^ Troy SM, Parker VP, Hicks DR, Pollack GM, Chiang ST (October 1997). "Pharmacokinetics and effect of food on the bioavailability of orally administered venlafaxine". Journal of Clinical Pharmacology. 37 (10): 954–961. doi:10.1002/j.1552-4604.1997.tb04270.x. PMID 9505987.
- ^ Wichniak A, Wierzbicka A, Walęcka M, Jernajczyk W (August 2017). "Effects of Antidepressants on Sleep". Current Psychiatry Reports. 19 (9): 63. doi:10.1007/s11920-017-0816-4. PMC 5548844
 . PMID 28791566.
. PMID 28791566.
- ^ "Helpful for chronic pain in addition to depression". Mayo Clinic. Diakses tanggal 2019-10-24.
- ^ Moncrieff J, Cooper RE, Stockmann T, Amendola S, Hengartner MP, Horowitz MA (August 2023). "The serotonin theory of depression: a systematic umbrella review of the evidence". Molecular Psychiatry. 28 (8): 3243–3256. doi:10.1038/s41380-022-01661-0
 . PMC 10618090
. PMC 10618090  Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 35854107 Periksa nilai|pmid=(bantuan). - ^ Nutt DJ (2008). "Relationship of neurotransmitters to the symptoms of major depressive disorder". The Journal of Clinical Psychiatry. 69: 4–7. PMID 18494537.
- ^ Sindrup SH, Otto M, Finnerup NB, Jensen TS (June 2005). "Antidepressants in the treatment of neuropathic pain". Basic & Clinical Pharmacology & Toxicology. 96 (6): 399–409. doi:10.1111/j.1742-7843.2005.pto_96696601.x
 . PMID 15910402.
. PMID 15910402.
- ^ Shelton RC, Miller AH (2011). "Inflammation in depression: is adiposity a cause?". Dialogues in Clinical Neuroscience. 13 (1): 41–53. doi:10.31887/DCNS.2011.13.1/rshelton. PMC 3181969
 . PMID 21485745.
. PMID 21485745.
- ^ a b Tynan RJ, Weidenhofer J, Hinwood M, Cairns MJ, Day TA, Walker FR (March 2012). "A comparative examination of the anti-inflammatory effects of SSRI and SNRI antidepressants on LPS stimulated microglia". Brain, Behavior, and Immunity. 26 (3): 469–479. doi:10.1016/j.bbi.2011.12.011. PMID 22251606.
- ^ "Cambridge University Press - Service Announcement".
- ^ Lambert O, Bourin M (November 2002). "SNRIs: mechanism of action and clinical features". Expert Review of Neurotherapeutics. 2 (6): 849–858. doi:10.1586/14737175.2.6.849. PMID 19810918.
- ^ a b c d "Pristiq Extended-Release- desvenlafaxine succinate tablet, extended release". DailyMed. 25 March 2022. Diakses tanggal 12 February 2023.
- ^ a b c d e "Effexor XR- venlafaxine hydrochloride capsule, extended release". DailyMed. 29 August 2022. Diakses tanggal 12 February 2023.
- ^ a b c d e "Savella- milnacipran hydrochloride tablet, film coated Savella- milnacipran hydrochloride kit". DailyMed. 23 December 2022. Diakses tanggal 12 February 2023.
- ^ a b Raouf M, Glogowski AJ, Bettinger JJ, Fudin J (August 2017). "Serotonin-norepinephrine reuptake inhibitors and the influence of binding affinity (Ki) on analgesia". Journal of Clinical Pharmacy and Therapeutics. 42 (4): 513–517. doi:10.1111/jcpt.12534
 . PMID 28503727.
. PMID 28503727.
- ^ a b c Upadhyaya HP, Desaiah D, Schuh KJ, Bymaster FP, Kallman MJ, Clarke DO, Durell TM, Trzepacz PT, Calligaro DO, Nisenbaum ES, Emmerson PJ, Schuh LM, Bickel WK, Allen AJ (March 2013). "A review of the abuse potential assessment of atomoxetine: a nonstimulant medication for attention-deficit/hyperactivity disorder". Psychopharmacology. Springer Nature. 226 (2): 189–200. doi:10.1007/s00213-013-2986-z. PMC 3579642
 . PMID 23397050.
. PMID 23397050.
- ^ Roth BL, Driscol J (Dec 2012). "PDSP Ki Database". Psychoactive Drug Screening Program (PDSP). University of North Carolina at Chapel Hill and the United States National Institute of Mental Health. Diakses tanggal 7 July 2018.
- ^ Boyer EW, Shannon M (March 2005). "The serotonin syndrome". The New England Journal of Medicine. 352 (11): 1112–1120. doi:10.1056/NEJMra041867. PMID 15784664.
- ^ Zhong Z, Wang L, Wen X, Liu Y, Fan Y, Liu Z (November 2017). "A meta-analysis of effects of selective serotonin reuptake inhibitors on blood pressure in depression treatment: outcomes from placebo and serotonin and noradrenaline reuptake inhibitor controlled trials". Neuropsychiatric Disease and Treatment. 13: 2781–2796. doi:10.2147/NDT.S141832
 . PMC 5683798
. PMC 5683798  . PMID 29158677.
. PMID 29158677.
- ^ McIntyre RS et al. The hepatic safety profile of duloxetine: a review. Expert Opin Drug Metab Toxicol. 2008;4(3):281–285.
- ^ Mladěnka P, Applová L, Patočka J, Costa VM, Remiao F, Pourová J, Mladěnka A, Karlíčková J, Jahodář L, Vopršalová M, Varner KJ, Štěrba M (July 2018). "Comprehensive review of cardiovascular toxicity of drugs and related agents". Medicinal Research Reviews. 38 (4): 1332–1403. doi:10.1002/med.21476. PMC 6033155
 . PMID 29315692.
. PMID 29315692.
- ^ "SNRI Antidepressants". poison.org. Diakses tanggal 2019-10-21.
- ^ Versiani M, Cassano G, Perugi G, Benedetti A, Mastalli L, Nardi A, Savino M (January 2002). "Reboxetine, a selective norepinephrine reuptake inhibitor, is an effective and well-tolerated treatment for panic disorder". The Journal of Clinical Psychiatry. 63 (1): 31–37. doi:10.4088/jcp.v63n0107. PMID 11838623.
- ^ Olivier JD, Olivier B (2019-09-01). "Antidepressants and Sexual Dysfunctions: a Translational Perspective". Current Sexual Health Reports. 11 (3): 156–166. doi:10.1007/s11930-019-00205-y
 .
.
- ^ Clayton AH, Montejo AL (2006). "Major depressive disorder, antidepressants, and sexual dysfunction". The Journal of Clinical Psychiatry. 67 (Suppl 6): 33–37. PMID 16848675.
- ^ Jing E, Straw-Wilson K (July 2016). "Sexual dysfunction in selective serotonin reuptake inhibitors (SSRIs) and potential solutions: A narrative literature review". The Mental Health Clinician. 6 (4): 191–196. doi:10.9740/mhc.2016.07.191. PMC 6007725
 . PMID 29955469.
. PMID 29955469.
- ^ "Serotonin syndrome: Preventing, recognizing, and treating it". www.mdedge.com. Diakses tanggal 2019-11-21.
- ^ a b Frank C (July 2008). "Recognition and treatment of serotonin syndrome". Canadian Family Physician. 54 (7): 988–992. PMC 2464814
 . PMID 18625822.
. PMID 18625822.
- ^ "SNRI Antidepressants". poison.org. Diakses tanggal 2019-10-23.
- ^ Tint A, Haddad PM, Anderson IM (May 2008). "The effect of rate of antidepressant tapering on the incidence of discontinuation symptoms: a randomised study". Journal of Psychopharmacology. 22 (3): 330–332. doi:10.1177/0269881107081550. PMID 18515448.
- ^ a b Cochran KA, Cavallari LH, Shapiro NL, Bishop JR (August 2011). "Bleeding incidence with concomitant use of antidepressants and warfarin". Therapeutic Drug Monitoring. 33 (4): 433–438. doi:10.1097/FTD.0b013e318224996e. PMC 3212440
 . PMID 21743381.
. PMID 21743381.
- ^ Cheng YL, Hu HY, Lin XH, Luo JC, Peng YL, Hou MC, Lin HC, Lee FY (November 2015). "Use of SSRI, But Not SNRI, Increased Upper and Lower Gastrointestinal Bleeding: A Nationwide Population-Based Cohort Study in Taiwan". Medicine. 94 (46): e2022. doi:10.1097/MD.0000000000002022. PMC 4652818
 . PMID 26579809.
. PMID 26579809.
- ^ Curr Neurol, Neurosci Rep. (2022). "Visual Snow: Updates on Pathology". Current Neurology and Neuroscience Reports. National Institutes of Health. 22 (3): 209–217. doi:10.1007/s11910-022-01182-x. PMC 8889058
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 35235167 Periksa nilai|pmid=(bantuan). - ^ "Duloxetine: Drug Information". UpToDate. Diakses tanggal 28 June 2012.
- ^ Perahia DG, Pritchett YL, Kajdasz DK, Bauer M, Jain R, Russell JM, Walker DJ, Spencer KA, Froud DM, Raskin J, Thase ME (January 2008). "A randomized, double-blind comparison of duloxetine and venlafaxine in the treatment of patients with major depressive disorder". Journal of Psychiatric Research. 42 (1): 22–34. doi:10.1016/j.jpsychires.2007.01.008. PMID 17445831.
- ^ Wilson E, Lader M (December 2015). "A review of the management of antidepressant discontinuation symptoms". Therapeutic Advances in Psychopharmacology. 5 (6): 357–368. doi:10.1177/2045125315612334. PMC 4722507
 . PMID 26834969.
. PMID 26834969.
- ^ a b Fava GA, Benasi G, Lucente M, Offidani E, Cosci F, Guidi J (2018). "Withdrawal Symptoms after Serotonin-Noradrenaline Reuptake Inhibitor Discontinuation: Systematic Review" (PDF). Psychotherapy and Psychosomatics. 87 (4): 195–203. doi:10.1159/000491524
 . PMID 30016772.
. PMID 30016772.
- ^ Taylor D, Lenox-Smith A, Bradley A (June 2013). "A review of the suitability of duloxetine and venlafaxine for use in patients with depression in primary care with a focus on cardiovascular safety, suicide and mortality due to antidepressant overdose". Therapeutic Advances in Psychopharmacology. 3 (3): 151–161. doi:10.1177/2045125312472890. PMC 3805457
 . PMID 24167687.
. PMID 24167687.
- ^ Simon LV, Hashmi MF, Keenaghan M (2019). "Serotonin Syndrome". StatPearls. StatPearls Publishing. PMID 29493999. Diakses tanggal 2019-11-21.
- ^ "2009 Top 200 branded drugs by total prescriptions" (PDF). SDI/Verispan, VONA, full year 2009. www.drugtopics.com. Diarsipkan dari versi asli (PDF) tanggal 14 July 2011. Diakses tanggal 6 April 2011.
- ^ Llorca PM, Fernandez JL (April 2007). "Escitalopram in the treatment of major depressive disorder: clinical efficacy, tolerability and cost-effectiveness vs. venlafaxine extended-release formulation". International Journal of Clinical Practice. 61 (4): 702–710. doi:10.1111/j.1742-1241.2007.01335.x
 . PMID 17394446.
. PMID 17394446.
- ^ Dubovicky M, Belovicova K, Csatlosova K, Bogi E (September 2017). "Risks of using SSRI / SNRI antidepressants during pregnancy and lactation". Interdisciplinary Toxicology. 10 (1): 30–34. doi:10.1515/intox-2017-0004. PMC 6096863
 . PMID 30123033.
. PMID 30123033.
- ^ Benevent J, Araujo M, Karki S, Delarue-Hurault C, Waser J, Lacroix I, Tebeka S, Damase-Michel C (July 2023). "Risk of Hypertensive Disorders of Pregnancy in Women Treated With Serotonin-Norepinephrine Reuptake Inhibitors: A Comparative Study Using the EFEMERIS Database". The Journal of Clinical Psychiatry (dalam bahasa English). 84 (4): 47872. doi:10.4088/JCP.22m14734. PMID 37437238 Periksa nilai
|pmid=(bantuan). - ^ Tran YH, Huynh HK, Faas MM, de Vos S, Groen H (February 2022). "Antidepressant use during pregnancy and development of preeclampsia: A focus on classes of action and specific transporters/receptors targeted by antidepressants". Journal of Psychiatric Research. 146: 92–101. doi:10.1016/j.jpsychires.2021.12.038. PMID 34959164 Periksa nilai
|pmid=(bantuan). - ^ Smith S, Martin F, Rai D, Forbes H (January 2024). "Association between antidepressant use during pregnancy and miscarriage: a systematic review and meta-analysis". BMJ Open. 14 (1): e074600. doi:10.1136/bmjopen-2023-074600. PMC 10824002
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 38272551 Periksa nilai|pmid=(bantuan). - ^ Wiggs KK, Sujan AC, Rickert ME, Quinn PD, Larsson H, Lichtenstein P, D'Onofrio BM, Oberg AS (June 2022). "Maternal Serotonergic Antidepressant Use in Pregnancy and Risk of Seizures in Children". Neurology. 98 (23): e2329–e2336. doi:10.1212/WNL.0000000000200516. PMC 9202527
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 35545445 Periksa nilai|pmid=(bantuan). - ^ a b Strawn JR, Mills JA, Sauley BA, Welge JA (April 2018). "The Impact of Antidepressant Dose and Class on Treatment Response in Pediatric Anxiety Disorders: A Meta-Analysis". Journal of the American Academy of Child and Adolescent Psychiatry. 57 (4): 235–244.e2. doi:10.1016/j.jaac.2018.01.015. PMC 5877120
 . PMID 29588049.
. PMID 29588049.
- ^ a b c d Strawn JR, Vaughn S, Ramsey LB (April 2022). "Pediatric Psychopharmacology for Depressive and Anxiety Disorders". Focus. 20 (2): 184–190. doi:10.1176/appi.focus.20210036. PMC 10153505
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 37153132 Periksa nilai|pmid=(bantuan). - ^ Strawn JR, Prakash A, Zhang Q, Pangallo BA, Stroud CE, Cai N, Findling RL (April 2015). "A randomized, placebo-controlled study of duloxetine for the treatment of children and adolescents with generalized anxiety disorder". Journal of the American Academy of Child and Adolescent Psychiatry. 54 (4): 283–293. doi:10.1016/j.jaac.2015.01.008. PMID 25791145.
- ^ Castagna PJ, Farahdel E, Potenza MN, Crowley MJ (May 2023). "The current state-of-the-art in pharmacotherapy for pediatric generalized anxiety disorder". Expert Opinion on Pharmacotherapy. 24 (7): 835–847. doi:10.1080/14656566.2023.2199921. PMC 10197951
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 37074259 Periksa nilai|pmid=(bantuan). - ^ Brender R, Mulsant BH, Blumberger DM (October 2021). "An update on antidepressant pharmacotherapy in late-life depression". Expert Opinion on Pharmacotherapy. 22 (14): 1909–1917. doi:10.1080/14656566.2021.1921736. PMID 33910422 Periksa nilai
|pmid=(bantuan). - ^ Mulsant BH, Blumberger DM, Ismail Z, Rabheru K, Rapoport MJ (August 2014). "A systematic approach to pharmacotherapy for geriatric major depression". Clinics in Geriatric Medicine. 30 (3): 517–534. doi:10.1016/j.cger.2014.05.002. PMC 4122285
 . PMID 25037293.
. PMID 25037293.
- ^ Simon G (October 2019). "Review: In older adults with acute major depression, SNRIs, but not SSRIs, increase adverse events vs placebo". Annals of Internal Medicine. 171 (8): JC39. doi:10.7326/acpj201910150-039. PMID 31610552.
- ^ "More adverse events with SNRIs than placebo in older patients". The Brown University Psychopharmacology Update (dalam bahasa Inggris). 30 (10): 7–8. October 2019. doi:10.1002/pu.30488. ISSN 1068-5308.
- ^ Ferreira GE, Abdel-Shaheed C, Underwood M, Finnerup NB, Day RO, McLachlan A, Eldabe S, Zadro JR, Maher CG (February 2023). "Efficacy, safety, and tolerability of antidepressants for pain in adults: overview of systematic reviews". BMJ. 380: e072415. doi:10.1136/bmj-2022-072415. PMC 9887507
 Periksa nilai
Periksa nilai |pmc=(bantuan). PMID 36725015 Periksa nilai|pmid=(bantuan).
