Uranium(III) klorida
| |
| Nama | |
|---|---|
| Nama IUPAC
Uranium(III) klorida
| |
| Nama lain
Uranium klorida
Uranium triklorida Hipourano klorida | |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| UCl3 | |
| Penampilan | Padatan kristalin hijau |
| Densitas | 5,500 g/cm3, cairan |
| Titik lebur | 837 °C (1.539 °F; 1.110 K) |
| Titik didih | 1.657 °C (3.015 °F; 1.930 K) |
| Larut | |
| Struktur | |
| Hibridisasi | Prisma trigonal bertudung-tiga |
| Bahaya | |
| Titik nyala | Tak mudah terbakar |
| Tak mudah terbakar | |
| Senyawa terkait | |
Senyawa terkait
|
Uranium(IV) klorida, Uranium(V) klorida, Uranium(VI) klorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Uranium(III) klorida, UCl3, adalah garam uranium yang larut dalam air. UCl3 sebagian besar digunakan untuk memproses ulang bahan bakar nuklir bekas. Uranium(III) klorida disintesis melalui berbagai cara dari uranium(IV) klorida; namun, UCl3 kurang stabil dibandingkan UCl4.
Pembuatan
[sunting | sunting sumber]Terdapat dua cara untuk menyintesis uranium(III) klorida. Proses-proses berikut ini menjelaskan cara memproduksi uranium(III) klorida.
(1) Dalam campuran NaCl–KCl pada suhu 670–710 °C, tambahkan uranium tetraklorida dengan logam uranium.
(2) Panaskan uranium(IV) klorida dalam gas hidrogen.
Sifat
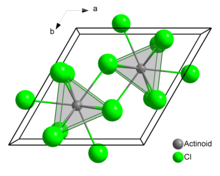
[sunting | sunting sumber]Dalam uranium(III) klorida padat, setiap atom uranium memiliki sembilan atom klorin sebagai tetangga dekat, pada jarak yang kurang lebih sama, dalam konfigurasi prisma trigonal bertudung-tiga.[3]
Uranium(III) klorida adalah padatan kristalin berwarna hijau pada suhu kamar. UCl3 melebur pada suhu 837 °C dan mendidih pada suhu 1657 °C. Uranium(III) klorida memiliki kerapatan sebesar 5500 kg/m3 atau 5,500 g/cm3.
Komposisinya berdasarkan berat:
- Klorin: 30,84%
- Uranium: 69,16%
Keadaan oksidatif formalnya:
- Klorin: −1
- Uranium: +3
Garam ini sangat larut dalam air dan juga sangat higroskopis. UCl3 lebih stabil dalam larutan asam klorida.[4]
Kegunaan
[sunting | sunting sumber]Reagen
[sunting | sunting sumber]Uranium(III) klorida digunakan dalam reaksi dengan tetrahidrofuran (THF) dan natrium metilsiklopentadiena untuk membuat berbagai kompleks metalosena uranium.[5]
Katalis
[sunting | sunting sumber]Uranium(III) klorida digunakan sebagai katalis selama reaksi antara litium aluminium hidrida (LiAlH4) dan olefin untuk menghasilkan senyawa alkil aluminat.[6]
Bentuk cair
[sunting | sunting sumber]Bentuk cair uranium(III) klorida adalah senyawa tipikal dalam proses pirokimia karena penting dalam pemrosesan ulang bahan bakar nuklir bekas.[7] UCl3 biasanya merupakan bentuk uranium yang digunakan sebagai bahan bakar bekas dalam proses pemurnian elektrik.[7][8]
Hidrat
[sunting | sunting sumber]Terdapat tiga bentuk hidrat dari uranium(III) klorida:
- UCl3.2H2O.2CH3CN
- UCl3.6H2O
- UCl3.7H2O
Masing-masing disintesis dengan mereduksi uranium(IV) klorida dalam metilsianida (asetonitril), dengan sejumlah air dan asam propionat.[9]
Pencegahan
[sunting | sunting sumber]Meskipun tidak ada data jangka panjang mengenai efek toksik dari UCl3, penting untuk meminimalkan paparan terhadap senyawa ini jika memungkinkan.
Serupa dengan senyawa uranium lainnya yang larut dalam air, UCl3 kemungkinan besar diserap ke dalam darah melalui kantong alveolar paru-paru dalam beberapa hari setelah terpapar. Paparan uranium(III) klorida menyebabkan toksisitas pada sistem ginjal.[10]
Referensi
[sunting | sunting sumber]- ^ Serrano, K.; Taxil, P.; Dugne, O.; Bouvet, S.; Puech, E. J. Nucl. Mater. 2000, 282, 137–145.
- ^ Remsen, Ira. Inorganic Chemistry. New York: Henry Holt and Company, 1890.
- ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ^ Comey, Arthur M.; Hahn, Dorothy A. A Dictionary of Chemical Solubilities: Inorganic. New York: The MacMillan Company, 1921.
- ^ Brenna, J.G.; Anderson, R.A.; Zalkin, A. Inorg. Chem. 1986, 25, 1756–1760.
- ^ Le Marechal, J.F.; Ephritikhine, M.; Folcher, G. J. Organomet. Chem. 1986, 309, C1–C3.
- ^ a b Okamoto, Y.; Madden, P.; Minato, K. J. Nucl. Mater. 2005, 344, 109–114.
- ^ Okamoto, Y.; Kobayashi, F.; Ogawa, T. J. Alloys Compd. 1998, 271, 355–358.
- ^ Mech, A.; Karbowick, M.; Lis, T. Polyhedron. 2006, 25, 2083–2092.
- ^ Bertell, Rosalie. "Gulf War Veterans and Depleted Uranium." May 1999. Available: http://ccnr.org/du_hague.html
Pranala luar
[sunting | sunting sumber]- (Inggris) Uranium(III) chloride information at Webelements
- (Inggris) Uranium(III) chloride International Bio-Analytical Industries, Inc.
- (Inggris) Depleted Uranium: All the Questions about DU and Gulf War Syndrome are Not Yet Answered
