Wolfram(IV) klorida
| |
| Nama | |
|---|---|
| Nama lain
wolfram tetraklorida
| |
| Penanda | |
Model 3D (JSmol)
|
|
| 3DMet | {{{3DMet}}} |
| ChemSpider | |
| Nomor EC | |
PubChem CID
|
|
| Nomor RTECS | {{{value}}} |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| Cl4W | |
| Massa molar | 325.65 g·mol−1 |
| Penampilan | padatan hitam |
| Densitas | 4.62 g·cm−3 |
| Titik lebur | 450 °C (842 °F; 723 K) |
| Bahaya | |
| Piktogram GHS |  
|
| Keterangan bahaya GHS | {{{value}}} |
| H302, H314 | |
| P260, P264, P270, P280, P301+312, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P330, P363, P405, P501 | |
| Senyawa terkait | |
Anion lain
|
Wolfram(IV) fluorida |
Senyawa terkait
|
Wolfram(V) klorida Wolfram heksaklorida |
Kecuali dinyatakan lain, data di atas berlaku pada suhu dan tekanan standar (25 °C [77 °F], 100 kPa). | |
| Referensi | |
Wolfram(IV) klorida adalah senyawa anorganik dengan rumus kimia WCl4. Senyawa ini merupakan padatan hitam diamagnetik. Senyawa ini menarik untuk diteliti sebagai salah satu dari beberapa klorida wolfram biner.
Struktur dan persiapan
[sunting | sunting sumber]WCl4 biasanya dibuat dengan mereduksi wolfram heksaklorida. Banyak reduktor yang telah dilaporkan, termasuk fosfor merah, wolfram heksakarbonil, galium, timah, dan antimon. Yang terakhir dilaporkan optimal:[1]
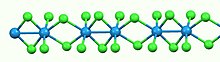
Seperti kebanyakan halida logam biner, WCl4 bersifat polimer. Ia terdiri dari rantai linier atom wolfram yang masing-masing berbentuk geometri oktahedral. Dari enam ligan klorida yang terikat pada setiap pusat W, empat merupakan ligan penghubung. Pemisahan WW secara bergantian bersifat mengikat (2,688 Å) dan tidak mengikat (3,787 Å).
Reaksi
[sunting | sunting sumber]Reduksi wolfram(IV) klorida dengan natrium menghasilkan turunan diwolfram(III) heptaklorida:[2]
- 2 WCl4 + 5 thf + 2 Na → [Na(thf)3][W2Cl7(thf)2] + NaCl
Referensi
[sunting | sunting sumber]- ^ Zhou, Yibo; Kolesnichenko, Vladimir; Messerle, Louis (2014). "Crystalline and Amorphous Forms of Tungsten Tetrachloride". Inorganic Syntheses: Volume 36. 36. hlm. 30–34. doi:10.1002/9781118744994.ch6. ISBN 978-1-118-74499-4.
- ^ Broderick, Erin M.; Browne, Samuel C.; Johnson, Marc J. A. (2014). "Dimolybdenum and Ditungsten Hexa(Alkoxides)". Inorganic Syntheses: Volume 36. 36. hlm. 95–102. doi:10.1002/9781118744994.ch18. ISBN 978-1-118-74499-4.

